
【题目】为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是

A. N极是负极
B. 该装置工作时,H+从右侧经阳离子交换膜移向左侧
C. 负极的电极反应为:(C6H10O5)n+7H2O﹣24e﹣═6CO2↑+24H+
D. 物质X是OH-
【答案】C
【解析】由题意利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,即为原电池,由图N极通O2,M极为有机物,则N极为正极发生还原反应,M极为负极,发生氧化反应,负极的电极反应为(C6H10O5)n]+7nH2O﹣24ne﹣═6nCO2↑+24nH+,原电池中阳离子移向正极,A.由图N极通O2,则N极为正极,选项A错误;B.原电池中阳离子移向正极,该装置工作时,H+从左侧经阳离子交换膜转向右侧,选项B错误;C.M极为有机物,M极为负极,发生氧化反应,负极的电极反应为(C6H10O5)n]+7nH2O﹣24ne﹣═6nCO2↑+24nH+,故C正确;D.由图N极通O2,则N极为正极,O2得电子结合H+生成水,物质X为水,选项D错误。答案选C。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】化学是一门非常重要的自然学科,在社会各领域中都发挥着重要的作用。
(1)黑火药是我国古代四大发明之一,其化学反应方程式为:![]()
①上述反应所涉及到的物质中属于非电解质的是________;
②上述反应中被还原的元素是________(填元素符号);
③收集上述反应生成的气体0.4mol,通入100mL![]() 的氢氧化钠溶液中,最终所得溶液中的溶质是________(填化学式);
的氢氧化钠溶液中,最终所得溶液中的溶质是________(填化学式);
(2)我国古代常用绿矾![]() 来制备硫酸,若将绿矾投入到稀硝酸中,发生反应的离子方程式为________;
来制备硫酸,若将绿矾投入到稀硝酸中,发生反应的离子方程式为________;
(3)在第一次世界大战期间,德军在比利时的伊普雷战役中使用了氯气制造的毒气弹。现代工业常用氯气制备漂白粉、消毒液等物质,写出制备84消毒液的离子反应方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3+2H+=CO2↑+H2O+Ba2+的H+不能代表的物质是( )
①HCl ②HNO3 ③CH3COOH ④NaHSO4 ⑤H2SO4
A.③B.③④⑤C.③⑤D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Cu2+、 CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)

下列说法不正确的是
A. 原溶液一定存在CO32-和SO42-,一定不存在Cu2+
B. 原溶液一定存在Cl-,可能存在Na+
C. 原溶液中c(Cl-) ≥0.1mol·L-1
D. 若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述正确的是

A. a和b不连接时,铁片上会发生氧化反应而质量减少
B. a和b用导线连接时,铜片上发生的反应为:Cu-2e-===Cu2+
C. 无论a和b是否连接,铁片均会被氧化,溶液均有Fe2+生成
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:__________________;
(2)实验中需加热至恒重的目的是:_________________________;
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_________________;
(2)实验中判断沉淀是否完全的方法是_______________________________。
方案三:按如图装置进行实验:

(1)B装置内所盛试剂是__________ 分液漏斗中____________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为____________________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:

(1)B中发生反应的离子方程式为_______________________________________________。
(2)为了获得纯净干燥的氯气,D中应放入的试剂为_______。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是__________________________。
(4)G是浸有淀粉KI溶液的棉花球,G 处现象是棉花球表面变成________________。
(5)整套装置存在不妥之处,原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是25℃时几种难溶电解质的溶度极数值:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.0×10-12 | 1.0×10-20 | 1.0×10-16 | 1.0×10-38 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为___________(填名称)而除去。
(2)①中加入的试剂应选择________为宜,其原因是_______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式__________________________________。
(4) 向浓度均为0.1mol/L-1的Fe(NO3)3和Cu(NO3)2混合溶液中,逐滴加入NaOH.下列示意图表示生成沉淀的总物质的量与加入NaOH的体积的关系,合理的是(____)
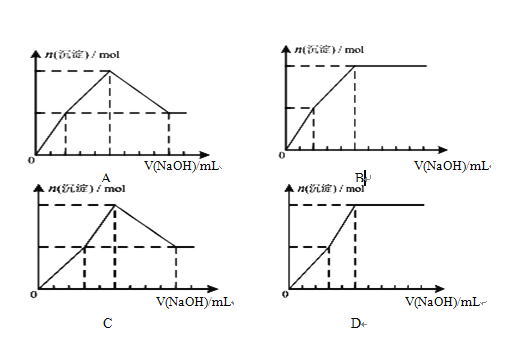
(5)若将某MgCl2、FeCl3均为0.1 mol·L-1混合溶液中的pH用MgO调整至pH=4,则溶液中![]() 比值约为______________________。
比值约为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关,下列有关说法中错误的是
A. 春节燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰
C. 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
D. 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com