
| A. | 0.1 mol•L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- | |
| B. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| C. | 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- | |
| D. | 0.1mol•L-1NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
分析 A.(NH4)2Fe(SO4)2电离出亚铁离子,高锰酸根离子能够氧化亚铁离子;
B.四种离子之间不反应,都不与氯化亚铁反应;
C.使甲基橙变红色的溶液中存在大量氢离子,次氯酸根离子与氢离子反应生成次氯酸;
D.碳酸氢根离子的酸性大于氢氧化铝,碳酸氢钠与偏铝酸根离子反应生成氢氧化铝沉淀.
解答 解:A.(NH4)2Fe(SO4)2电离出的亚铁离子具有还原性,能够被MnO4-氧化,在溶液中不能大量共存,故A错误;
B.K+、Na+、SO42-、NO3-之间不发生反应,都不与FeCl2反应,在溶液中能够大量共存,故B正确;
C.使甲基橙变红色的溶液为酸性溶液,溶液中存在大量氢离子,ClO-与氢离子结合生成次氯酸,在溶液中不能大量共存,故C错误;
D.碳酸氢根离子的酸性大于氢氧化铝,NaHCO3与AlO2-反应生成氢氧化铝沉淀和碳酸钠,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
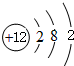 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4无论在水溶液或熔融状态下都可以电离出Na+、H+和SO42- | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极,铜不易失去电子而受到保护 | |
| C. | 外电路电子流入的一极为正极电子流出的一极为负极 | |
| D. | 负极发生还原反应,正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 溴苯(液溴) | NaOH溶液 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 所有的碳原子在同一个平面上 | B. | 能发生水解但不能发生消去反应 | ||
| C. | 能与AgNO3溶液生成浅黄色沉淀 | D. | 能够发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com