
| A. | $\frac{a}{4b}$mol-1 | B. | $\frac{b}{4a}$mol-1 | C. | $\frac{a}{4b}$ | D. | $\frac{b}{4a}$ |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,H2O2的结构式为H-O-O-H,N-H键的键能为a kJ•mol-1,N-N键的键能为b kJ•mol-1,H-O键的键能为c kJ•mol-1,O-O键的键能为d kJ•mol-1,
,H2O2的结构式为H-O-O-H,N-H键的键能为a kJ•mol-1,N-N键的键能为b kJ•mol-1,H-O键的键能为c kJ•mol-1,O-O键的键能为d kJ•mol-1, 键的键能为e kJ•mol-1,则1mol N2H4与足量H2O2反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=(4a+b-4c+d-e)kJ•mol-1.
键的键能为e kJ•mol-1,则1mol N2H4与足量H2O2反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=(4a+b-4c+d-e)kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol Ne含有的电子数目为10NA | |
| B. | 0.2NA个硫酸分子与19.6g磷酸含有相同的氧原子数 | |
| C. | 2.8g氮气所含的分子数为NA | |
| D. | 1.8gNH4+中含有的质子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
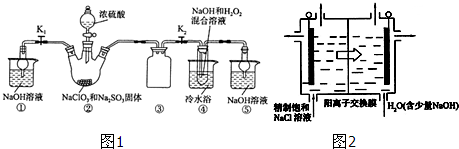
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CO32-+7H2O.
CO32-+7H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com