
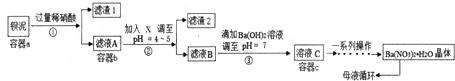
分析 钡泥[主要含FeCO3、BaSO3等],加入过量稀硝酸,在a容器中充分溶解,过滤后可得滤渣1为硫酸钡,滤液A中含有铁离子、钡离子等,且溶液呈酸性,调节溶液pH=4~5时,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液B中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,
(1)根据$c=\frac{1000ρω}{M}$可计算出硝酸的浓度;
(2)BaSO3与硝酸发生氧化还原反应生成一氧化氮和硫酸钡沉淀,根据电荷守恒和元素守恒书写离子方程式;
(3)调节溶液pH=4~5时,使铁离子水解生成Fe(OH)3沉淀,X既要能中和硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;
(4)根据过滤的操作所用到的仪器判断;
(5)根据母液中的成分判断;
(6)根据$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$计算;
(7)根据沉淀硫酸钡的质量,结合方程式计算求出硝酸钡的质量,再求样品的纯度.
解答 解:钡泥[主要含FeCO3、BaSO3等],加入过量稀硝酸,在a容器中充分溶解,过滤后可得滤渣1为硫酸钡,滤液A中含有铁离子、钡离子等,且溶液呈酸性,调节溶液pH=4~5时,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液B中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,
(1)根据$c=\frac{1000ρω}{M}$可知硝酸的浓度为c=$\frac{1000×1.12×21%}{63}$mol/L=3.73 mol/L,
故答案为:3.73 mol/L;
(2)BaSO3与硝酸发生氧化还原反应生成一氧化氮和硫酸钡沉淀,反应的离子方程式为3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O,
故答案为:3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O;
(3)调节溶液pH=4~5时,使铁离子水解生成Fe(OH)3沉淀,X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,故选d,
故答案为:使Fe3+完全沉淀为Fe(OH)3;d;
(4)过滤操作,需要使用的硅酸盐仪器有烧杯、胶头滴管和 漏斗、玻璃棒,
故答案为:漏斗、玻璃棒;
(5)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液应该,循环到容器c中,
故答案为:c;
(6)根据$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$可知,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{1.1×10{\;}^{-10}}{5.1×10{\;}^{-9}}$=0.022,
故答案为:0.022;
(7)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2•H2O+H2SO4=BaSO4+2HNO3
279 233
x mg
则 $\frac{279}{x}$=$\frac{233}{mg}$,解得x=$\frac{279m}{233}$,所以该Ba(NO3)2•H2O的纯度为$\frac{\frac{279m}{233}}{w}$×100%=$\frac{279m}{233w}$×100%,
故答案为:$\frac{279m}{233w}$×100%.
点评 本题以钡泥制取Ba(NO3)2•H2O晶体为载体,综合考查学生对新信息的处理能力、分析能力和实验能力,题目难度中等,注意把握实验原理和方法.


科目:高中化学 来源: 题型:选择题
| A. | 还原性:F->Cl->Br->I- | |
| B. | 酸性:碳酸>石碳酸>碳酸氢钠>氢氧化铝 | |
| C. | 氧化性:Na>S>F2>O2 | |
| D. | NaHCO3溶液:c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C15H31COOH和C17H35COOH是同系物 | |
| B. | 结构不同,性质相同,化学式相同的物质互称同分异构体 | |
| C. | 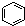 和 和 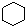 均是芳香烃, 均是芳香烃,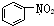 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| D. | 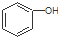 和 和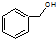 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+) | |
| B. | 常温时向NH4HSO4溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)=c(SO42-) | |
| C. | AgCl的Ksp=1.8×10-10 mol2•L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2•L-2 | |
| D. | 将10 mL 0.1 mol/L Na2SO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中:c(Na+)>c(Cl-)>c(HSO3-)>c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该分子中氮原子的杂化方式为sp2和sp3.
,该分子中氮原子的杂化方式为sp2和sp3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com