
| A. | ①③⑤⑥ | B. | ③④⑤⑥ | C. | ②④⑤⑥ | D. | ①③④⑤ |
分析 ①强酸溶液加水稀释后,溶液中氢离子浓度降低,氢氧根离子浓度增大;
②c(H+)=10-pH;
③任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
④△G=△H-T△S>0时,该反应不能自发进行;
⑤酸的电离平衡常数、酸根离子水解平衡常数与水的离子积常数之间的关系为Ka•Kh=Kw;
⑥反应A(g)?2B(g),若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,反应的焓变等于正逆反应活化能之差.
解答 解:①pH=1的强酸溶液,加水稀释后,溶液中c(H+)减小,温度不变,则水的离子积常数不变,则c(OH-)增大,故错误;
②c(H+)=10-pH,pH=2的盐酸和pH=1的醋酸,c(H+)之比为=0.01mol/L:0.1mol/L=1:10,故错误;
③混合溶液呈存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),存在物料守恒c(NH3•H2O)+c(NH4+)=2c(Cl-),所以得c(NH4+)+2c(H+)=2c(OH-)+c(NH3•H2O),故正确;
④△G=△H-T△S>0时,该反应不能自发进行,根据方程式知△S>0,但该反应中△H一定大于0,故正确;
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh,水的离子积为Kw,则三者关系为:Ka•Kh=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$$•\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=Kw,故正确;
⑥逆反应的活化能=正反应的活化能+反应的焓变,所以△H=逆反应的活化能-正反应的活化能=(Ea-Eb)kJ•mol-1,故正确;
故选B.
点评 本题考查较综合,涉及弱电解质的电离、盐类水解、焓变、pH的计算等知识点,注意稀释酸或碱中并不是所有粒子都减小,知道酸的电离平衡常数、酸根离子水解平衡常数与离子积常数之间的关系式,题目难度不大.


科目:高中化学 来源: 题型:解答题
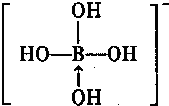 .(若存在配位键需标出)
.(若存在配位键需标出)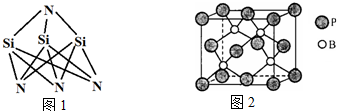
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
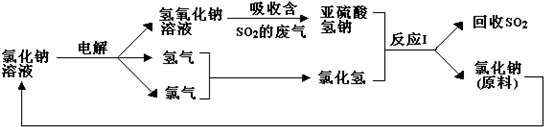
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的一氯代物只有一种 | B. | 苯的邻位二氯代物只有一种 | ||
| C. | 苯的间位二氯代物只有一种 | D. | 苯的对位二氯代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
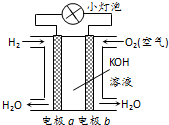
| A. | 电极a是负极 | |
| B. | 电极a上的电极反应为2H2-4e-=4H+ | |
| C. | 外电路中电子由电极a流向电极b | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子半径、失电子能力随核电荷数的增加而增大 | |
| B. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随核电荷数的增加而加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②⑤不可以 | D. | ③④可以 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com