
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Al(OH)3 | C. | [Al(OH)4]- | D. | Al3+和Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

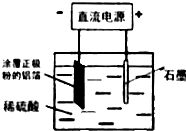
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 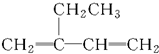 2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | B. | CH2=CH-CH2-CH3 1-丁烯 | ||
| C. | 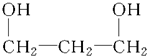 1,3-二丙醇 1,3-二丙醇 | D. | 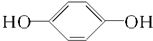 1,4-苯二酚 1,4-苯二酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯元素的相对原子质量为$\frac{12b}{a}$ | |
| B. | mg该氯原子的物质的量一定是$\frac{m}{(a{N}_{A})}$mol | |
| C. | 该氯元素的摩尔质量是aNA | |
| D. | ng该氯原子所含的电子数为$\frac{n}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
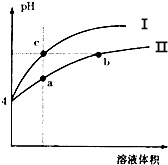
| A. | Ⅰ为氯化铵溶液稀释时pH值变化曲线 | |
| B. | b点比c点溶液的导电能力强 | |
| C. | a点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| D. | b点比a点溶液中的水的电离程度大,但两点的KW相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
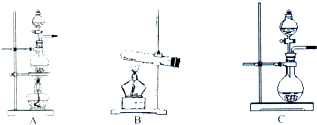 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C |
| ② | 制氨气 | NH4Cl→NH3 | B |
| ③ | 制氯气 | HCl→Cl2 | A或C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com