
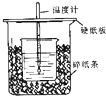
 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| A、工业上通过电解熔融状态MgCl2制取金属镁 |
| B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C、在第②、④步骤中,溴元素均被氧化 |
| D、制取NaHCO3的反应是利用其溶解度小于NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸 |
| ① |
| 稀硝酸、盐酸 |
| ② |
| ③ |
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 和一个-Cl,它可能的结构有四种,试写出其中的三种结构简式.
和一个-Cl,它可能的结构有四种,试写出其中的三种结构简式.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、1.4g CO完全燃烧放出热量为28.3kJ |
| B、CO(g)+Na2O2(s)═Na2CO3(s)△H=-509kJ?mol-1 |
| C、2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452kJ?mol-1 |
| D、CO2(g)与Na2O2(s)反应放出226kJ热量时,电子转移为2×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com