
【题目】铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水。
I、还原沉淀法是处理含Cr2O42— 和CrO72—工业废水的一种常用方法,其工艺流程如下:
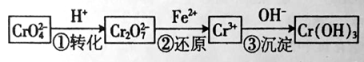
其中第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
(1)若平衡体系中,pH=0时溶液显 色。
(2)以石墨为电极,电解Na2CrO4制备Na2Cr2O7的装置如图所示。
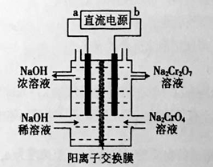
a极的名称是 ;b极直接相连一极的反应式为 。
(3)第②步反应的离子方程式: 。
第②步反应后的溶液加入一定量烧碱,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)= mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38 mol·L—1,Ksp[Cr(OH)3]=6.0x10—31 mol·L—1)。
II、探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:
aCrO3+bC2H5OH+cH2SO4=dCr2(SO4)3+eCH3COOH+fR
b:c:f= 。
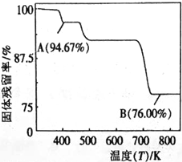
(5)CrO3的热稳定性差,加热时逐步分解,其固定残留率随温度的变化如图所示。B点时生成固体的化学式为 。(固体残留率= ![]() )
)
【答案】(1)橙;
(2)负极;2H2O―4e―=4H++O2↑;
(3)Cr2O72―+6Fe2++14H+=2Cr3++6Fe3++7H2O;3×10―5;
(4)1:2:3;
(5)Cr2O3;
【解析】
试题分析:(1)①若平衡体系的pH=2,溶液酸性较强,平衡2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O正向移动,溶液呈橙色,故答案为:橙;
(2)根据2CrO42-+2H+ ![]() Cr2O72-+H2O设计图示装置,电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明该电极是阳极,连接电源的正极,则a电极为阴极,连接电源的负极,阳极的电极反应式为2H2O―4e―=4H++O2↑,故答案为:负极;2H2O―4e―=4H++O2↑;
Cr2O72-+H2O设计图示装置,电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明该电极是阳极,连接电源的正极,则a电极为阴极,连接电源的负极,阳极的电极反应式为2H2O―4e―=4H++O2↑,故答案为:负极;2H2O―4e―=4H++O2↑;
(3)亚铁离子与Cr2O72-发生氧化还原反应,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10-12molL-1,则c(OH-)=![]() mol/L,c(Cr3+)=3×10-5,故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;3×10-5;
mol/L,c(Cr3+)=3×10-5,故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;3×10-5;
(4)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,aCrO3+bC2H5OH+cH2SO4= dCr2(SO4)3+ eCH3COOH +fR中b:c:f=1:2:3故答案为:1:2:3;
(5)设固体质量为100g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为![]() :
:![]() =2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3,故答案为:Cr2O3。
=2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3,故答案为:Cr2O3。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g) ![]() 2C(g)+D(g);H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减少
C.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
D.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C 的体积分数的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
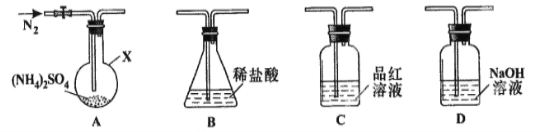
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2,品红溶液不褪色。已知中和装置B中剩余盐酸需0.2000mol/L NaOH溶液25.00 mL,且中和后的溶液中无SO42-。
(1)仪器X的名称是________________;
(2)装置B内溶液吸收气体的物质的量是__________mol;
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(3)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是 ;
(4)装置B内溶液吸收的气体是 ;
(5)(NH4)2SO4在400℃分解的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质或原子结构的递变,叙述不正确的是( )
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl元素最高正化合价依次增大
C. N、O、F得电子能力依次减弱
D. LiOH、NaOH、KOH的碱性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H7Cl的有机物,其结构不可能是( )
A. 只有一个双键的直链有机物 B. 含有两个双键的直链有机物
C. 含有一个双键的环状有机物 D. 含有一个三键的直链有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种变化中,不属于化学变化的是
A.向鸡蛋白溶液中滴入饱和硫酸铵溶液,析出白色沉淀
B.加热胆矾得到白色的无水硫酸铜粉末
C.向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体
D.向鸡蛋白溶液中滴入硝酸铅溶液,析出白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com