
【题目】二硫化钼(MoS2)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及 CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
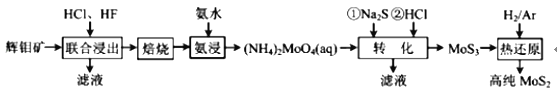
回答下列问题:
(1)(NH4)2MoO4中Mo的化合价为_____。
(2)“联合浸出”中HF除去的杂质化学式为_____,“焙烧”时MoS2转化为MoO3的化学方程式为_____。
(3)“转化”中加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出(NH4)2MoS4与盐酸生成MoS3的离子方程式_____。
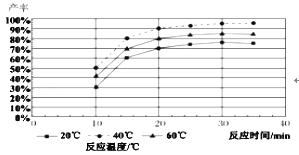
(4)由图分析产生MoS3沉淀的流程中应选择的最优温度和时间是_____,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因_____。
(5)高纯MoS2中存在极微量非整比晶体杂质MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为_____。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的 Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当SO42-完全沉淀时,溶液中c(MoO42-)<_____mol/L(保留2位有效数字)
【答案】+6 SiO2 2MoS2+7O2![]() 2MoO3+4SO2 MoS42-+2H+=MoS3↓+H2S↑ 40 ℃、30 min 温度太低不利于H2S 逸出;温度太高,盐酸挥发,溶液c(H+)下降,都不利于反应正向进行 1∶4 3.6×10-3
2MoO3+4SO2 MoS42-+2H+=MoS3↓+H2S↑ 40 ℃、30 min 温度太低不利于H2S 逸出;温度太高,盐酸挥发,溶液c(H+)下降,都不利于反应正向进行 1∶4 3.6×10-3
【解析】
制备高纯二硫化钼的流程为:辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)用盐酸、氢氟酸酸浸,除去CuFeS2、SiO2杂质,得到粗MoS2,将粗MoS2洗涤、干燥、氧化焙烧得到MoO3;再将MoO3氨浸得到(NH4)2MoO4;加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],再加入盐酸,(NH4)2MoS4与盐酸生成MoS3沉淀:MoS42-+2H+=MoS3↓+H2S↑,最后通过干燥、研磨,在氢气、Ar环境下高温获得高纯的二硫化钼MoS2。
(1)化学式中(NH4)2MoO4中,NH4+带一个单位正电荷,O元素为-2价,则Mo的化合价为+6价;
(2)氢氟酸可以与二氧化硅反应得到四氟化硅气体,从而除去SiO2杂质;焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2![]() 2MoO3+4SO2;
2MoO3+4SO2;
(3)(NH4)2MoS4在溶液中电离出NH4+和MoS42-,MoS42-与盐酸电离产生的H+作用生成MoS3,则另外的生成物是H2S气体,反应的离子反应方程式为:MoS42-+2H+=MoS3↓+H2S↑;
(4)由图象得到40℃的产率最高,30分钟以后产率不再变化,所以产生MoS3沉淀选择d 最优条件是40℃,30min;温度太低,反应MoS42-+2H+=MoS3↓+H2S↑产生的H2S气体不易逸出,不利于生成MoS3;若温度太高,盐酸挥发,导致溶液c(H+)下降,也不利于生成MoS3,所以最优温度为40℃;
(5)设在1 mol的MoS2.8中Mo4+与Mo6+的物质的量分别是x和y,则x+y=1,根据化合价代数之和为0,则有4x+6y=2.8×2,解得x=0.2,y=0.8,所以该杂质中Mo4+与Mo6+的物质的量之比为0.2:0.8=1:4;
(6)已知:Ksp(BaSO4)=1.1×10-10< Ksp(BaMoO4)=4.0×10-8,所以先沉淀的是BaSO4,则当BaMoO4开始沉淀时,BaSO4已经沉淀完全,所以溶液对于两种沉淀来说都是饱和的,其中的离子浓度都符合沉淀的Ksp表达式: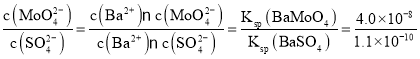 =360=3.6×102,则当SO42-完全沉淀时,溶液中c(SO42-)<1×10-5 mol/L,c(MoO42-)<3.6×102×1×10-5 mol/L=3.6×10-3 mol/L。
=360=3.6×102,则当SO42-完全沉淀时,溶液中c(SO42-)<1×10-5 mol/L,c(MoO42-)<3.6×102×1×10-5 mol/L=3.6×10-3 mol/L。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为_______________ 。
(2)生产农药的原料 PSCl3 中 P、S、Cl 的第一电离能由大到小的顺序为____电负性由大到小的顺序为__________________________。
(3)H2SO4为粘稠状 难挥发性的酸 ,而 HNO3 是易挥发的酸,其原因是__________
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为________,所含共价 键的类型为_____________,N2O与CO2互为等电子体 ,且N2O 分子中O只与一个N相连,则N2O的电子式为_______________ 。
(5)AlP 因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。

①磷化铝的晶体类型为 _____________________ 。
②A、B 点的原子坐标如图所示,则C点的原子坐标为 __________________ 。
③磷化铝的晶胞参数a = 546.35 pm(l pm=10—12 m), 其密度为________g/cm3( 列出计算式即可,用NA表示阿伏加德罗常数的数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是

A.用水湿润的pH试纸测量某溶液的pH
B.用量筒量取20 mL0.5000 mol·L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol· L-1H2SO4溶液
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置除去Cl2中的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇的化学方程式为:CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
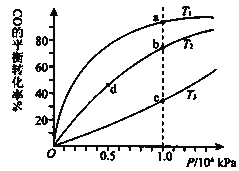
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量M(a)<M(c) M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)的主要用途是制造特种钢,用CO还原MoO3(白色粉末,加热时变黄)制备单质Mo的装置如图。下列说法正确的是

A.装置②中盛有饱和Na2CO3溶液,装置③中盛有浓硫酸,作用是净化CO2
B.装置①中的稀盐酸可用稀硫酸代替,石灰石可用碳酸钠粉末代替
C.装置④的作用是制备CO,装置⑤的作用是CO还原MoO3
D.装置⑥能达到检验MoO3是否被CO还原的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)乙炔在Pd表面选择加氢的反应机理如图,其中吸附在Pd表面上的物种用*标注。

上述反应为_____(填“放热”或“吸热”)反应,历程中最小能垒(活化能)为_____kJ/mol,该步骤的化学方程式为_____。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术。原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。
5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。

A.用催化剂A前50s平均反应速率v(N2)=2.5×10﹣2 mol/(Ls)
B.体系各物质状态不变时,反应在任何温度下均可自发进行
C.分离出体系中的H2O(g)有利于氮氧化物的脱除
D.用催化剂C达到平衡时,N2产率最小
(3)废气的变废为宝越来越成为人们共同关注的焦点,某化学课外小组查阅资料得知:
2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)![]() N2O2(g) (快) v1正=k1正c2(NO),v1逆═k1逆c(N2O2) △H1<0
N2O2(g) (快) v1正=k1正c2(NO),v1逆═k1逆c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2) △H2<0
2NO2(g)(慢) v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2) △H2<0
请回答下列问题:
①一定温度下,2NO(g)+O2(g)![]() 2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
②研究发现NO转化为NO2的反应速率随温度的升高而减慢,原因是_____。
③已知:N2O4(g)![]() 2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。
2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃结构式如下:![]() -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )
A.所有原子可能在同一平面上
B.所有原子可能在同一条直线上
C.所有碳原子可能在同一平面上
D.处在同一平面上的原子最多有20个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
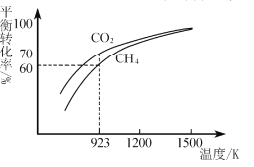
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
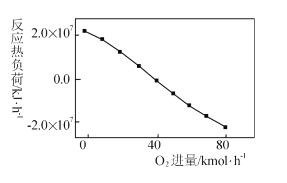
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com