
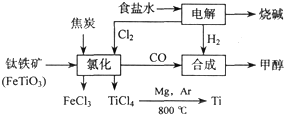
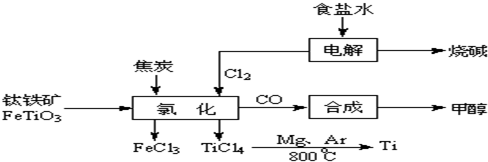
(15分)钛(Ti)被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减小环境污染。请填写下列空白:
(1)电解饱和食盐水时,该反应的离子方程式是____________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);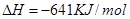
②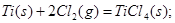
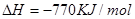
则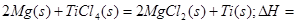 ____________
____________
反应: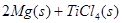
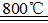
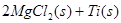 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________
(3)写出钛铁矿与焦炭、Cl2共热制得四氯化钛的化学方程式______________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时正极区溶液的PH_____(填“增大”、“减小”或“不变”)该电池中负极上的电极反应是__________.
(5)在上述产业链中合成96t甲醇理论上消耗H2_________t(不考虑生产过程中物质的任何损失)
(1)(2分)2Cl-+2H2O  Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(2)-512 KJ/mol (2分)
Mg和Ti都有较强还原性,在高温下都易与空气中的O2反应(2分)
(3)2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO(3分)
2FeCl3+2TiCl4+6CO(3分)
(4)增大(2分) CH3OH-6e-+8OH-=CO32-+6H2O(2分) (5)12 (2分)
解析试题分析::(1)电解食盐水生成NaOH、H2和Cl2,
利用盖斯定律2①-②即可计算出反应热为-512 KJ/mol。由于Mg和Ti都有较强还原性,在高温下都易与空气中的O2反应,所以反应要在Ar气氛中进行。
(3在碱性环境中正极: O2 + 4e- + 2H2O= 4OH- ,所以正极附近的碱性增强。负极甲醇发生氧化反应,CH3OH-6e-+8OH-=CO32-+6H2O
(5)CO(g)+2H2(g)←→ CH3OH(g)
4 32
X 96t
x="12" t
考点:电解食盐水、盖斯定律、燃料电池的原理
点评:本题以学生不熟悉的金属钛(Ti)为题眼,结合化学工艺,考查的知识面广,但是设计的知识点简单。注重对基础知识点的考查。


科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:
2MgCl2(s)+Ti,在Ar气氛中进行的理由是:查看答案和解析>>
科目:高中化学 来源: 题型:
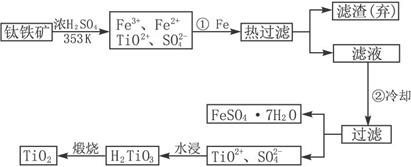
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com