
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应中属于这种情况的是( )
①过量的锌与浓硫酸反应;②过量的氢气与少量的N2在工业生产条件下反应;③过量的浓盐酸与碳酸钙反应;④过量的乙酸和少量乙醇在浓硫酸、加热条件下反应;⑤过量二氧化锰与浓盐酸在加热条件下反应;⑥过量的铜与浓硫酸在加热条件下反应
| A.②③④⑥ | B.②④⑤⑥ |
| C.①②④⑤ | D.③④⑤⑥ |
科目:高中化学 来源: 题型:单选题
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
己知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O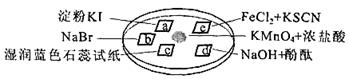
对实验现象的“解释或结论”正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+ > Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO 3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。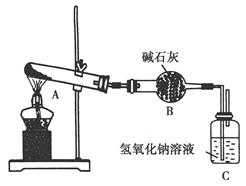
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑ 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑ 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑ 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学为探究SO2与Ba2+只有在碱性条件下才能形成BaSO3沉淀,设计了如下方案,你认为可行的是( )
| A.将SO2通入Ba(OH)2溶液中观察有白色沉淀生成 |
| B.将SO2通入Ba(NO3)2溶液中观察有白色沉淀生成 |
| C.将SO2分别通入BaCl2溶液、BaCl2与HCl的混合溶液、Ba(OH)2溶液中,观察到只有Ba(OH)2中有白色沉淀生成 |
| D.将SO2通入BaCl2与NH3的混合溶液中有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,澄清石灰水变浑浊。若打开活塞,则品红溶液褪色,石蕊试液变红,澄清石灰水变浑浊。据此判断该气体和广口瓶中盛放的物质分别是( )
| A.CO2和浓H2SO4 |
| B.SO2和NaHCO3溶液 |
| C.Cl2和NaHCO3溶液 |
| D.Cl2和饱和氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是( )
A.Cu+HNO3(浓) Cu(NO3)2 Cu(NO3)2 |
B.Cu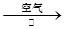 CuO CuO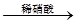 Cu(NO3)2 Cu(NO3)2 |
C.Cu+HNO3(稀)  Cu(NO3)2 Cu(NO3)2 |
D.Cu CuSO4 CuSO4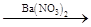 Cu(NO3)2 Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被溶液充满,关于原来试管中盛装的气体不正确的猜测是( )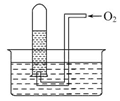
| A.可能是N2与NO2的混合气体 |
| B.可能是O2与NO2的混合气体 |
| C.可能是NO与NO2的混合气体 |
| D.可能是NO2一种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应,下列有关说法不合理的是( )
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中正确的是( )
| A.实验室制取氨气的发生装置与用高锰酸钾制取氧气的装置相同 |
| B.并不是所有的铵盐都能与烧碱共热生成氨气 |
| C.除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO |
| D.CO2、NO2、P2O5均与水反应生成酸为酸性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com