

| 实验操作 | 预期现象与结论 |
| 步骤1: | |
| 步骤2: | |
| … | |
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入足量的稀盐酸 | 若闻到刺激性气味,说明白色固体含有Na2SO3. |
| 步骤2:在步骤1的溶液加入足量的氯化钡溶液 | 若有白色沉淀生成,则说明白色固体含Na2SO4. 若步骤1现象明显,而步骤2没明显现象,则说明白色固体为Na2SO3;若步骤1现象不明显,步骤2现象明显,则说明白色固体为Na2SO4;若上述两个实验现象均有,则说明白色固体既含有Na2SO3,又含有Na2SO4。 |


科目:高中化学 来源:不详 题型:实验题
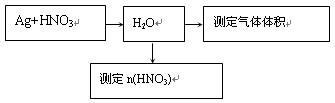
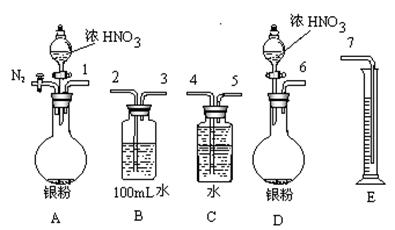
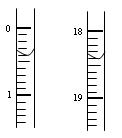
| | 滴定前读读数/mL | 滴定后读数/mL |
| 第一次 | | |
| 第二次 | 0.10 | 18.00 |
| 第三次 | 0.20 | 18.30 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
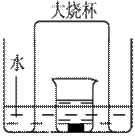
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.64 g SO2含有氧原子数为1NA |
| B.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1NA |
| C.标准状况下,22.4 L H2O的分子数为1NA |
| D.常温常压下,14 g N2含有分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 | D.硫氰化钾溶液 |
| 同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | | |
| 第二种方法 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.一定含有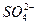 、Ag+中的一种或几种 、Ag+中的一种或几种 |
B.一定含有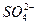 或Ag+,不含 或Ag+,不含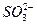 |
C.一定含有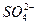 或 或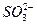 或Ag+ 或Ag+ |
D.一定含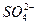 、 、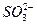 、Ag+中的一种或几种 、Ag+中的一种或几种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验内容 | 实验现象 | 实验结论 |
(1)Na、Mg(条)、K与水反应 | 同一周期自左而右元素原子失电子的能力逐渐______;同一主族自上而下元素原子失电子能力依次______. | |
(2)Mg、Al与酸反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
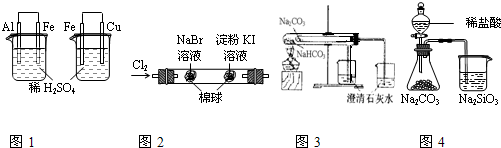
| 实验现象 | 结论 | |
| A | 图1左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 图2左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 图3左边烧杯变浑浊,右边烧杯不变浑浊 | 热稳定性:Na2CO3>NaHCO3 |
| D | 图4锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com