
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•mol-1①
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),其反应热进行相应的改变,据此计算反应热;
(4)已知:①C(s)+O2(g)=CO2(g)△H=-437.3kJ•mol一1
②H2(g)+1/2O2(g)=H2O(g)△H=-285.8kJ•mol一1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律计算,①-②-③得到固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式,根据反应②和③可计算出水煤气燃烧放出的热量.
解答 解:(1)4g CO在氧气中燃烧生成CO2,放出 9.6kJ热量,28g一氧化碳在氧气中燃烧放出热量=$\frac{28}{4}$×9.6KJ=67.2KJ,则CO燃烧的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=-134.4kJ•mol一1,
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-134.4kJ•mol一1.;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1;
(3)碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•mol-1①
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),则△H=(3a+b-c)kJ•mol-1,
故答案为:(3a+b-c)kJ•mol-1;
(4)已知:①C(s)+O2(g)=CO2(g)△H=-437.3kJ•mol一1
②H2(g)+1/2O2(g)=H2O(g)△H=-285.8kJ•mol一1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律计算,①-②-③得到固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是:C(s)+H2O(g)=CO2(g)+H2(g)△H=-131.5kJ•mol-1;
故答案为:C(s)+H2O(g)=CO2(g)+H2(g)△H=-131.5kJ•mol-1,根据反应②③可知,每2摩尔水煤气完全燃烧放出的热量为285.8kJ+283.0kJ=568.8kJ,所以10m3(标况)即$\frac{10000}{22.4}$mol=446.43mol的水煤气完全燃烧放出的热量为446.43×568.8kJ×$\frac{1}{2}$=126964.7 kJ,
故答案为:C(s)+H2O(g)=CO2(g)+H2(g)△H=-131.5kJ•mol-1;126964.7.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 含最高价元素的化合物,一定具有氧化性 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 失电子越多,还原性越强 | |
| D. | 一种物质是氧化剂时,同时必然有另一种物质是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=+725.8kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1451.6kJ/mol | |
| C. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=-725.8kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=+1451.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(l)△H=-2Q kJ•mol-1 | |
| B. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(l)△H=-4Q kJ•mol-1 | |
| C. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(l)△H=-Q kJ•mol-1 | |
| D. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(g)△H=-4Q kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol | |
| D. | 已知:C(s)+O2(g)=CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
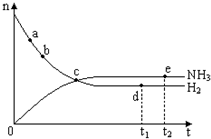 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点 c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,573K下反应至t1时刻,n(H2)比图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (氧化剂)
(氧化剂)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | |
| D | E | F |
 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com