
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
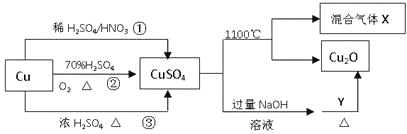
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为2:3
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.已知1molCuSO4在1100℃所得混合气体X为SO2和O2,则O2为0.75mol
D.Y可以是葡萄糖
【答案】A
【解析】
A. 途径①发生反应的化学方程式为3H2SO4+2HNO3+3Cu=3CuSO4+2NO↑+4H2O,所用混酸中H2SO4与HNO3物质的量之比最好为3:2,A说法不正确;
B. 途径①产生大气污染物氮的氧化物,途径③产生大气污染物二氧化硫,而途径②不产生大气污染物,且酸的利用率高,因此,相对于途径①、③,途径②更好地体现了绿色化学思想,B说法正确;
C. 已知1molCuSO4在1100℃所得混合气体X为SO2和O2,因为Cu元素的化合价由+2降到+1, S元素的化合价由+6降到+4,O元素的化合价由-2升高到0,根据电子转移守恒可知,1mol+2mol=4n(O2),则O2为0.75mol,C说法正确;
D. 硫酸铜可以与过量的氢氧化钠溶液反应生成氢氧化铜悬浊液,氢氧化铜悬浊液可以被含有醛基的有机物还原为氧化亚铜,葡萄糖分子中含有醛基,则Y可以是葡萄糖,D说法正确。
本题选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭体系中进行的可逆反应:A(g)+2B(g)![]() C(g)+D(g),下列不能说明反应达到平衡状态的是
C(g)+D(g),下列不能说明反应达到平衡状态的是
A.![]() 正(B)=2
正(B)=2![]() 逆(C)B.n(A):n(D)=1:1
逆(C)B.n(A):n(D)=1:1
C.容器内压强不再改变D.容器内混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题。
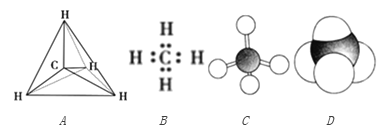
(1)甲烷的比例模型是________,甲烷的电子式是__________ (填序号)。
(2)写出甲烷与氯气发生反应的化学方程式_____________(只写第一步),该反应的反应类型是________________。
(3)相对分子质量为100的烷烃的分子式是_______________。
(4)甲烷与丙烷互为________。
A. 同位素 B. 同素异形体 C. 同系物 D. 同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢是危害性极强的毒性气体,也是恶臭气体的主要成分之一。![]() 菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法正确的是( )
菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法正确的是( )
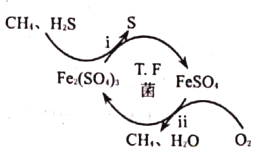
A.![]() 在脱硫过程中被还原
在脱硫过程中被还原
B.温度越高,越有利于天然气的催化脱硫
C.该脱硫过程需要不断添加![]() 溶液
溶液
D.理论上,需要氧气的体积是相同状态下![]() 体积的一半
体积的一半
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
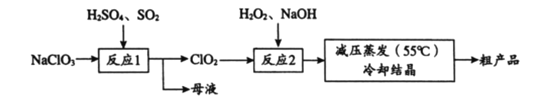
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92g,经如下处理:

已知氯化铁溶液可用于腐蚀印刷电路铜板的离子反应为:Cu+2Fe3+=Cu2++2Fe2+
下列说法正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+
②样品中氧元素的物质的量为0.03mol
③溶解样品的过程中消耗硫酸的总物质的量为0.04mol
④V=224
⑤V=336
A.①③④B.②③④C.②③⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J是我国自主研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
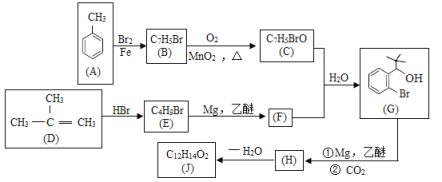
已知:
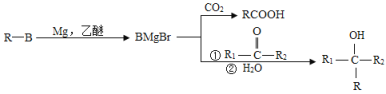
回答下列问题:
(1)B的结构简式是______;C中的官能团名称是____。
(2)D生成E的化学方程式为________。
(3)H→J的反应类型是_________。
H在一定条件下自身缩聚生成高分子化合物的结构简式是_______。
(4)根据![]() ,X的分子式为_____。X有多种同分异构体,其中满足下列条件的同分异构体共有______ 种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为_____。X有多种同分异构体,其中满足下列条件的同分异构体共有______ 种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无-O-O-键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯为原料,合成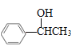 路线流程图(其它试剂自选):_______。
路线流程图(其它试剂自选):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用海底锰结核(主要成分为MnO2,含少量MgO、Fe2O3、Al2O3、SiO2)为原料,制备金属锰、镁的一种工艺流程路线如下:
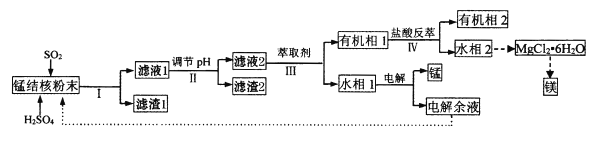
已知:①几种难溶物的溶度积(25℃)如下表所示:
化学式 | Mg(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 |
Ksp | 1.8×10-11 | 1.8×10-13 | 1.0×10-33 | 4.0×10-38 |
②溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全。
完成下列问题:
(1)“锰结核粉末”中MnO2与SO2反应的离子方程式为_____。
(2)“滤液1”中c(Mn2+)为0.18mol·L-1,则“调节pH”的范围为_______,“滤渣2”的成分为______。
(3)“Ⅲ”处“萃取剂”萃取的成分是___;“Ⅳ”处用“盐酸反萃”的作用是____。
(4)MgCl2·6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为__________。
(5)该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为____。
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式____________。
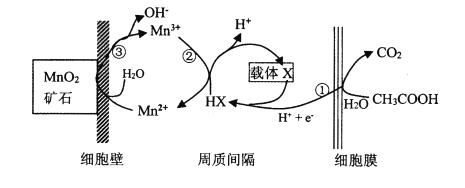
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
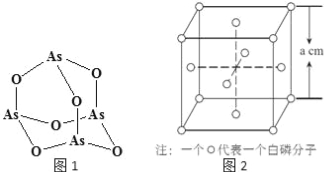
(1)As原子的核外电子排布式为 。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是 。
(3)NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角 (填“大”或“小”),原因是 。
(4)Na3AsO4中含有的化学键类型包括 ;AsO43﹣的空间构型为 ,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 。
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是 晶体.
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).己知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l,则该晶胞中含有的P原子的个数为 ,该晶体的密度为 gcm﹣3(用含NA、a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com