
分析 A、B、C、D、E是短周期中的元素,它们的原子序数依次增大;A元素原子形成的离子核外电子数为0,则A为H元素;
B原子的最外层电子数是内层电子数的2倍,则B有2个电子层,最外层电子数为4,故B为C元素;
E的单质为黄色晶体,则E为S元素;
E元素与D元素同主族,则D为O元素;
C、D在元素周期表中处于相邻的位置,原子序数小于O元素,则C为N元素,据此解答.
解答 解:A、B、C、D、E是短周期中的元素,它们的原子序数依次增大;A元素原子形成的离子核外电子数为0,则A为H元素;
B原子的最外层电子数是内层电子数的2倍,则B有2个电子层,最外层电子数为4,故B为C元素;
E的单质为黄色晶体,则E为S元素;
E元素与D元素同主族,则D为O元素;
C、D在元素周期表中处于相邻的位置,原子序数小于O元素,则C为N元素,
(1)由上述分析可知,C元素的名称为氮,故答案为:氮;
(2)A、D、E三元素组成的化合物为硫酸、亚硫酸,硫酸和亚硫酸中只含共价键,故答案为:共价键;
(3)上述元素中O元素非金属性最强,故氢化物稳定性最强的是H2O,故答案为:H2O;
(4)H、C、N、O四元素形成的离子化合物的化学式为NH4HCO3 或 (NH4)2CO3,故答案为:NH4HCO3 或 (NH4)2CO3.
点评 本题考查结构性质位置高关系,比较基础,推断元素是解题关键,有利于基础知识的巩固,注意(4)中形成的离子化合物还有碳酸氢铵,易漏掉,


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
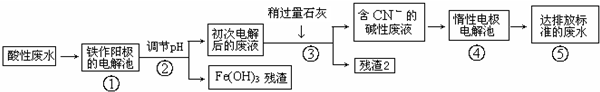
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的轨道表示式: | B. | Na+的结构示意图: | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:[Ne]3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 戊二醛的分子式为C5H8O2,符合此分子式的二元醛有5种 | |
| B. | 戊二醛不能使酸性高锰酸钾溶液褪色 | |
| C. | 戊二醛经催化氧化可以得到的戊二酸有4种同分异构体 | |
| D. | 1mol的戊二醛与足量的银氨溶液反应,最多可得2mol单质银 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )| A. | 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- | |
| B. | 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ | |
| C. | 晶体中与每个K+距离最近的K+有8个 | |
| D. | 晶体中,0价氧与-2价氧的数目比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com