
”¾ĢāÄæ”æĮņĖįÄųŹĒµē¶Ę¹¤Ņµ±Ų²»æÉÉŁµÄ»Æ¹¤ŌĮĻ”£“Ó²»ŠāøÖ·ĻŌü(Ö÷ŅŖŗ¬Fe 42.35%”¢Cr 9.67%”¢Ni 5.1%”¢C 4.7%”¢Si 3.39%µČ)ÖŠÖĘČ”ĮņĖįÄų¾§ĢåµÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ

ŅŃÖŖ£ŗ¢ŁCr3+Óė°±Ė®·“Ó¦Ź±ÓŠÉŁĮæCr3+Éś³É[Cr(NH3)6]3+£¬µ«¼ÓČČŹ±øĆĀēŗĻĪļŅ×·Ö½ā”£Ni2+Óė°±Ė®·“Ӧɜ³É[Ni(NH3)6]2+£¬øĆĀēŗĻĪļ¼ÓČČŹ±ĪČ¶Ø£¬ÓĆĮņĖįĖį»ÆŹ±Éś³ÉĻąÓ¦µÄĮņĖįŃĪ”£
¢ŚNa2CrO4ČÜŅŗÖŠ¼ÓĖįµ÷½ŚpHĪŖ3.5Ź±£¬CrO42©×Ŗ»ÆĪŖCr2O72©”£
¢ŪĻą¹ŲĪļÖŹŌŚ²»Ķ¬ĪĀ¶ČŹ±Čܽā¶ČČēĻĀ±ķ£ŗ
ĪĀ¶ČČܽā¶Č/gĪļÖŹ | 20”ę | 30”ę | 40”ę | 60”ę | 80”ę | 90”ę |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)”°Ėį½ž”±ŗóµĆµ½µÄČÜŅŗÖŠÖ÷ŅŖŗ¬ÓŠFeSO4”¢NiSO4”¢Cr2(SO4)3£¬Éś³ÉNiSO4µÄ»Æѧ·½³ĢŹ½ĪŖ_____”£”°Ėį½ž”±Ź±ŠčæŲÖĘĪĀ¶ČĪŖ90”ę×óÓŅ£¬æÉŅŌ²ÉÓĆµÄ¼ÓČČ·½Ź½ŹĒ_____”£
(2)”°¹żĀĖ”±Ē°£¬ŹŹµ±¼ÓČȵÄÄæµÄŹĒ_____”£
(3)¶Ō”°¹żĀĖ”±ĖłµĆµÄĀĖŌü½ųŠŠĻ“µÓ£¬¼ģŃéĀĖŌüŅŃĻ“µÓøɾ»µÄ·½·ØŹĒ_____”£
(4)”°¹żĀĖ”±Ź±²śÉśµÄĀĖŌüæÉÓĆÓŚÖʱøNa2Cr2O7¾§Ģ唣
¢ŁĀĖŌü¾øÉŌļŗóÓėNa2CO3»ģŗĻŌŚæÕĘųÖŠģŃÉÕÉś³ÉNa2CrO4ŗĶCO2£¬“Ė·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_____”£
¢ŚĒė²¹³äĶźÕūÉĻŹöģŃÉÕŗó»ģŗĻĪļÖʱøNa2Cr2O7¾§Ģå(³ČŗģÉ«)µÄŹµŃé·½°ø£ŗĖ®½ž£¬¹żĀĖ£¬_____£¬µĆNa2Cr2O7¾§Ģå(±ŲŠėŹ¹ÓƵďŌ¼ĮÓŠ£ŗĮņĖį£¬ÕōĮóĖ®)”£
”¾“š°ø”æNi+H2SO4ØTNiSO4+H2”ü 90”ęĖ®Ō”¼ÓČČ Ź¹[Cr(NH3)6]3+·Ö½āÉś³ÉCr(OH)3³Įµķ ȔɣĮæ×īŗóŅ»“ĪĻ“µÓ¹żĀĖŅŗÓŚŹŌ¹ÜÖŠ£¬ĻČÓĆŃĪĖįĖį»Æ£¬ŌŁ¼ÓČėBaCl2ČÜŅŗ£¬ČōĪŽ³ĮµķÉś³É£¬ŌņŅŃĻ“¾» 4Cr(OH)3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2+6H2O ĻņĀĖŅŗÖŠ¼ÓČėĮņĖįµ÷½ŚpHÖĮ3.5£¬½«ČÜŅŗ¼ÓČȵ½90”ę(ŅŌÉĻ)Õō·¢½į¾§£¬ÓŠ“óĮæĪŽÉ«¾§ĢåĪö³ö£¬ÖĮÓŠÉŁĮæ³ČŗģÉ«¾§ĢåĪö³öŹ±³ĆČČ¹żĀĖ£¬ĀĖŅŗ½µĪĀÖĮ40”ę½į¾§£¬¹żĀĖ£¬ÓĆÕōĮóĖ®Ļ“µÓ£¬øÉŌļ
4Na2CrO4+4CO2+6H2O ĻņĀĖŅŗÖŠ¼ÓČėĮņĖįµ÷½ŚpHÖĮ3.5£¬½«ČÜŅŗ¼ÓČȵ½90”ę(ŅŌÉĻ)Õō·¢½į¾§£¬ÓŠ“óĮæĪŽÉ«¾§ĢåĪö³ö£¬ÖĮÓŠÉŁĮæ³ČŗģÉ«¾§ĢåĪö³öŹ±³ĆČČ¹żĀĖ£¬ĀĖŅŗ½µĪĀÖĮ40”ę½į¾§£¬¹żĀĖ£¬ÓĆÕōĮóĖ®Ļ“µÓ£¬øÉŌļ
”¾½āĪö”æ
“Ó²»ŠāøÖ·ĻŌü(Ö÷ŅŖŗ¬Fe 42.35%”¢Cr 9.67%”¢Ni 5.1%”¢C 4.7%”¢Si 3.39%µČ)£¬ÓÉŹµŃéĮ÷³ĢæÉÖŖ£¬ĮņĖįČܽā·ÖĄė³ö²ŠŌüĪŖSi”¢C£¬”°Ėį½ž”±ŗóµĆµ½µÄČÜŅŗÖŠÖ÷ŅŖŗ¬ÓŠFeSO4”¢NiSO4”¢Cr2(SO4)3£¬Č»ŗó½į¾§·ÖĄė³öĀĢ·Æ£¬½į¾§ŠÅĻ¢æÉÖŖ¼Ó°±Ė®Éś³É[Cr(NH3)6]3+£¬µ«¼ÓČČŹ±øĆĀēŗĻĪļŅ×·Ö½ā£¬¶ųNi2+Óė°±Ė®·“Ӧɜ³É[Ni(NH3)6]2+£¬øĆĀēŗĻĪļ¼ÓČČŹ±ĪČ¶Ø£¬¹żĀĖ·ÖĄė³ö[Ni(NH3)6]2+£¬ÓĆĮņĖįĖį»ÆŹ±Éś³ÉNiSO4£¬Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ·ÖĄė³öĮņĖįÄų¾§Ģ壬ŅŌ“ĖĄ“½ā“š”£
“Ó²»ŠāøÖ·ĻŌü(Ö÷ŅŖŗ¬Fe 42.35%”¢Cr 9.67%”¢Ni 5.1%”¢C 4.7%”¢Si 3.39%µČ)£¬ÓÉŹµŃéĮ÷³ĢæÉÖŖ£¬ĮņĖįČܽā·ÖĄė³ö²ŠŌüĪŖSi”¢C£¬”°Ėį½ž”±ŗóµĆµ½µÄČÜŅŗÖŠÖ÷ŅŖŗ¬ÓŠFeSO4”¢NiSO4”¢Cr2(SO4)3£¬Č»ŗó½į¾§·ÖĄė³öĀĢ·Æ£¬½į¾§ŠÅĻ¢æÉÖŖ¼Ó°±Ė®Éś³É[Cr(NH3)6]3+£¬µ«¼ÓČČŹ±øĆĀēŗĻĪļŅ×·Ö½ā£¬¶ųNi2+Óė°±Ė®·“Ӧɜ³É[Ni(NH3)6]2+£¬øĆĀēŗĻĪļ¼ÓČČŹ±ĪČ¶Ø£¬¹żĀĖ·ÖĄė³ö[Ni(NH3)6]2+£¬ÓĆĮņĖįĖį»ÆŹ±Éś³ÉNiSO4£¬Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ·ÖĄė³öĮņĖįÄų¾§Ģ壬Ōņ
(1)Éś³ÉNiSO4µÄ»Æѧ·½³ĢŹ½ĪŖNi+H2SO4ØTNiSO4+H2”ü£¬”°Ėį½ž”±Ź±ŠčæŲÖĘĪĀ¶ČĪŖ90”ę×óÓŅ£¬æÉŅŌ²ÉÓĆµÄ¼ÓČČ·½Ź½ŹĒ90”ęĖ®Ō”¼ÓČČ£»
(2)”°¹żĀĖ”±Ē°£¬ŹŹµ±¼ÓČȵÄÄæµÄŹĒŹ¹[Cr(NH3)6]3+·Ö½āÉś³ÉCr(OH)3³Įµķ£»
(3)¶Ō”°¹żĀĖ”±ĖłµĆµÄĀĖŌü½ųŠŠĻ“µÓ£¬¼ģŃéĀĖŌüŅŃĻ“µÓøɾ»µÄ·½·ØŹĒ¼ģŃéŹĒ·ńŗ¬ÓŠĮņĖįøłĄė×Ó£¬¼“ȔɣĮæ×īŗóŅ»“ĪĻ“µÓ¹żĀĖŅŗÓŚŹŌ¹ÜÖŠ£¬ĻČÓĆŃĪĖįĖį»Æ£¬ŌŁ¼ÓČėBaCl2ČÜŅŗ£¬ČōĪŽ³ĮµķÉś³É£¬ŌņŅŃĻ“¾»£»
(4)¢ŁĀĖŌü¾øÉŌļŗóÓėNa2CO3»ģŗĻŌŚæÕĘųÖŠģŃÉÕÉś³ÉNa2CrO4ŗĶCO2£¬“Ė·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ4Cr(OH)3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2+6H2O£»
4Na2CrO4+4CO2+6H2O£»
¢Śøł¾ŻĢāøÉŠÅĻ¢æÉÖŖÖʱøNa2Cr2O7¾§Ģå(³ČŗģÉ«)µÄŹµŃé·½°ø£ŗĖ®½ž£¬¹żĀĖ£¬ĻņĀĖŅŗÖŠ¼ÓČėĮņĖįµ÷½ŚpHÖĮ3.5£¬½«ČÜŅŗ¼ÓČȵ½90”ę(ŅŌÉĻ)Õō·¢½į¾§£¬ÓŠ“óĮæĪŽÉ«¾§ĢåĪö³ö£¬ÖĮÓŠÉŁĮæ³ČŗģÉ«¾§ĢåĪö³öŹ±³ĆČČ¹żĀĖ£¬ĀĖŅŗ½µĪĀÖĮ40”ę½į¾§£¬¹żĀĖ£¬ÓĆÕōĮóĖ®Ļ“µÓ£¬øÉŌļ£¬µĆNa2Cr2O7¾§Ģ唣



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲĖµ·Ø£¬²»ÕżČ·µÄŹĒ£Ø £©
A. 1molÄūĆŹĻ©£Ø £©ŌŚŅ»¶ØĢõ¼žĻĀæÉŅŌøś2mol H2¼Ó³É
£©ŌŚŅ»¶ØĢõ¼žĻĀæÉŅŌøś2mol H2¼Ó³É
B. ĖłÓŠĶéĢžŌŚ¹āÕÕĢõ¼žĻĀ¶¼ÄÜøśĀČĘų·¢ÉśČ”“ś·“Ó¦
C. ĻąĶ¬ÖŹĮæµÄ±ūĶ锢±ūĻ©”¢±ūČ²3ÖÖĪļÖŹĶźČ«Č¼ÉÕ£¬±ūĶéĻūŗĵÄŃõĘų×ī¶ą
D. ÓĆĖįŠŌKMnO4ČÜŅŗ¼ų±šŅŅĻ©ŗĶŅŅČ²
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗćĪĀĢõ¼žĻĀ£¬æÉÄę·“Ó¦£ŗ2NO£Øg£©+O2£Øg£©![]() 2NO2£Øg£©ŌŚĢå»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾µÄŹĒ£Ø””””£©
2NO2£Øg£©ŌŚĢå»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾µÄŹĒ£Ø””””£©
¢Łµ„Ī»Ź±¼äÄŚÉś³Én mol O2µÄĶ¬Ź±Éś³É2n mol NO2¢Śµ„Ī»Ź±¼äÄŚÉś³Én mol O2µÄĶ¬Ź±Éś³É2n mol NO¢ŪÓĆNO2”¢NO”¢O2±ķŹ¾µÄ·“Ó¦ĖŁĀŹµÄ±ČĪŖ2£ŗ2£ŗ1µÄדĢ¬¢Ü»ģŗĻĘųĢåµÄŃÕÉ«²»ŌŁøıäµÄדĢ¬¢Ż»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁøıäµÄדĢ¬¢Ž»ģŗĻĘųĢåµÄŃ¹Ēæ²»ŌŁøıäµÄדĢ¬¢ß»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁøıäµÄדĢ¬£®
A. ¢Ł¢Ü¢Ž¢ß B. ¢Ś¢Ū¢Ż¢ß C. ¢Ł¢Ū¢Ü¢Ż D. Č«²æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠæŖ·¢ŗĶÓ¦ÓĆµÄ¹ćĄ«Ē°¾°£¬¹¤ŅµÉĻŅ»°ćæɲÉÓĆČēĻĀ·“Ó¦Ą“ŗĻ³É¼×“¼£ŗ CO(g)+2H2(g) ![]() CH3OH(g)£¬ĻÖŌŚŹµŃéŹŅÄ£ÄāøĆ·“Ó¦²¢½ųŠŠ·ÖĪö”£
CH3OH(g)£¬ĻÖŌŚŹµŃéŹŅÄ£ÄāøĆ·“Ó¦²¢½ųŠŠ·ÖĪö”£
£Ø1£©ĻĀĶ¼ŹĒøĆ·“Ó¦ŌŚ²»Ķ¬ĪĀ¶ČĻĀCOµÄ×Ŗ»ÆĀŹĖꏱ¼ä±ä»ÆµÄĒśĻß”£

¢ŁøĆ·“Ó¦µÄģŹ±ä¦¤H__________0(Ģī”°£¾”±”¢”°£¼”±»ņ”°£½”±)”£
¢ŚT1ŗĶT2ĪĀ¶ČĻĀµÄĘ½ŗā³£Źż“󊔹ŲĻµŹĒK1_______K2 (Ģī ”°£¾”±”¢”°£¼”±»ņ”°£½”±)”£
¢ŪČōČŻĘ÷ČŻ»ż²»±ä£¬ĻĀĮŠ“ėŹ©æÉŌö¼Ó¼×“¼²śĀŹµÄŹĒ______________”£
A£®ÉżøßĪĀ¶Č B£®½«CH3OH(g)“ÓĢåĻµÖŠ·ÖĄė
C£®Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮ D£®³äČėHe£¬Ź¹ĢåĻµ×ÜŃ¹ĒæŌö“ó
£Ø2£©ŌŚČŻ»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬ÓÉCO2ŗĶH2ŗĻ³É¼×“¼£¬ŌŚĘäĖūĢõ¼ž²»±äµÄĒéæöĻĀ£¬æ¼²ģĪĀ¶Č¶Ō·“Ó¦µÄÓ°Ļģ£¬ČēĶ¼ĖłŹ¾
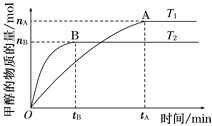
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ________(ĢīŠņŗÅ)£»
¢ŁĪĀ¶ČĪŖT1Ź±£¬“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬Éś³É¼×“¼µÄĘ½¾łĖŁĀŹĪŖv(CH3OH)£½nA/tAmol”¤L£1”¤min£1
¢ŚøĆ·“Ó¦ŌŚT1Ź±µÄĘ½ŗā³£Źż±ČT2Ź±µÄŠ”
¢ŪøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦
¢Ü“¦ÓŚAµćµÄ·“Ó¦ĢåĻµ“ÓT1±äµ½T2£¬“ļµ½Ę½ŗāŹ±![]() Ōö“ó
Ōö“ó
£Ø3£©ŌŚT1ĪĀ¶ČŹ±£¬½«1 mol CO2ŗĶ3 mol H2³äČėŅ»ĆܱÕŗćČŻČŻĘ÷ÖŠ£¬³ä·Ö·“Ó¦“ļµ½Ę½ŗāŗó£¬ČōCO2µÄ×Ŗ»ÆĀŹĪŖ¦Į£¬ŌņČŻĘ÷ÄŚµÄŃ¹ĒæÓėĘšŹ¼Ń¹ĒæÖ®±ČĪŖ_____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲŹĀŹµ£¬ÓėĖ®½ā·“Ó¦ĪŽ¹ŲµÄŹĒ
A. Čȵēæ¼īČÜŅŗÓĆÓŚĒåĻ“ÓĶĪŪ
B. ĀČ»ÆĢśČÜŅŗøÆŹ“Ķ°å
C. ¼ÓČČÕōøÉĀČ»ÆĢśČÜŅŗ£¬²»ÄܵƵ½ĀČ»ÆĢś¾§Ģå
D. ÓĆTiCl4ŗĶ“óĮæĖ®·“Ó¦£¬Ķ¬Ź±¼ÓČČÖʱøTiO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆܱÕČŻĘ÷ÖŠ½ųŠŠµÄæÉÄę·“Ó¦£ŗaA£Øg£©£«bB£Øg£©![]() cC£Øg£©ŌŚ²»Ķ¬ĪĀ¶Č£ØT1ŗĶT2£©¼°Ń¹Ēæ£Øp1ŗĶp2£©ĻĀ£¬»ģŗĻĘųĢåÖŠBµÄÖŹĮæ·ÖŹżw£ØB£©Óė·“Ó¦Ź±¼ä£Øt£©µÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
cC£Øg£©ŌŚ²»Ķ¬ĪĀ¶Č£ØT1ŗĶT2£©¼°Ń¹Ēæ£Øp1ŗĶp2£©ĻĀ£¬»ģŗĻĘųĢåÖŠBµÄÖŹĮæ·ÖŹżw£ØB£©Óė·“Ó¦Ź±¼ä£Øt£©µÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ

A£®T1<T2£¬p1<p2£¬a£«b>c£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦
B£®T1>T2£¬p1<p2£¬a£«b<c£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦
C£®T1<T2£¬p1>p2£¬a£«b<c£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦
D£®T1>T2£¬p1>p2£¬a£«b>c£¬Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅĄūÓĆ·ĻĘś¾Éµē³ŲµÄĶƱ£ØÖ÷ŅŖ³É·ÖĪŖZnŗĶCu£©»ŲŹÕCu²¢ÖʱøZnOµÄ²æ·ÖŹµŃé¹ż³ĢČēĶ¼ĖłŹ¾£ŗ

ĻĀĮŠŠšŹö“ķĪóµÄŹĒ£Ø £©
A. ”°Čܽā”±²Ł×÷ÖŠæÉÓĆĖįŠŌĢõ¼žĻĀ²»¶Ļ¹ÄČėO2“śĢęH2O2
B. ĶƱČܽāŗ󣬽«ČÜŅŗ¼ÓČČÖĮ·ŠĢŚŅŌ³żČ„ČÜŅŗÖŠ¹żĮæµÄH2O2
C. Óė¼ÓČėŠæ·Ū·“Ó¦µÄĄė×ÓĪŖCu2+”¢H+
D. ”°¹żĀĖ”±²Ł×÷ŗ󣬽«ĀĖŅŗÕōøÉ”¢øßĪĀ×ĘÉÕ¼“æÉÖĘČ”“æ¾»µÄZnO
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»ÖÖŠĀŠĶµÄĖ«Ąė×Óæɳäµēµē³ŲµÄŌĄķČēĶ¼ĖłŹ¾£¬ŅŌĻĀĖµ·ØÕżČ·µÄŹĒ

A. µē¼«a·¢ÉśµÄ·“Ó¦ĪŖ»¹Ō·“Ó¦
B. ³äµēŹ±a¼«ÓėµēŌ“µÄÕż¼«ĻąĮ¬
C. Õż¼«·¢ÉśµÄµē¼«·“Ó¦æÉÄÜĪŖ£ŗCaFeO3+e£=CaFeO2.5+1/2O2£
D. ·ÅµēŹ±£¬Ćæµ±ÓŠNAøöNa+ŅĘĻņb¼«£¬ĶāµēĀ·ÖŠŅ»¶Ø×ŖŅĘ2NAøöµē×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æVmLFe2£ØSO4£©3ČÜŅŗÖŠŗ¬ÓŠFe3+ag£¬Č”![]() mLČÜŅŗĻ”ŹĶµ½5VmL£¬ŌņĻ”ŹĶŗóČÜŅŗÖŠSO42©µÄĪļÖŹµÄĮæÅØ¶ČŹĒ
mLČÜŅŗĻ”ŹĶµ½5VmL£¬ŌņĻ”ŹĶŗóČÜŅŗÖŠSO42©µÄĪļÖŹµÄĮæÅØ¶ČŹĒ
A.![]() mol/LB.
mol/LB.![]() mol/L
mol/L
C.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com