
| A、8.96L |
| B、4.48L |
| C、44.8L |
| D、2.24L |
科目:高中化学 来源: 题型:
| A、①②③④ | B、①③④② |
| C、②①④③ | D、④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有反应物的键能之和小于所有生成物的键能之和的反应为放热反应 |
| B、所有反应物的总能量小于所有生成物的总能量的反应为放热反应 |
| C、中和热与化学反应方程式的计量数成正比 |
| D、葡萄糖在人体内与氧气的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
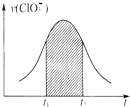 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵座标为V(H+)的V-t曲线与图中曲线完全重合 |
| C、后期反应速率下降的主要原因是反应物浓度减小 |
| D、图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水,阳极反应式一定为:2Cl--2e-=Cl2↑ |
| B、无论是原电池还是电解池中,电子均不能通过电解质溶液 |
| C、电解精炼铜时,粗铜作阴极 |
| D、为保护地下钢管不受腐蚀,可使它与铜板相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:99 | B、1:1 |
| C、1:99 | D、1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com