
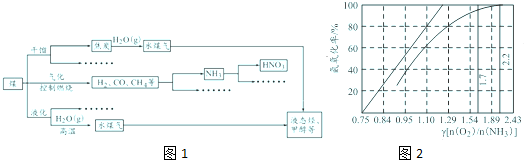
| 在微生物作用下 |
| O2/H2O |
| 在微生物作用下 |
| O2/H+ |
| ||
| 高温高压 |
| 5 |
| 4 |


科目:高中化学 来源: 题型:
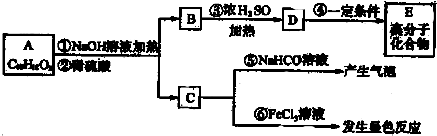
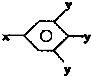 (其中-x、一y均为官能团).请回答下列问题:
(其中-x、一y均为官能团).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 用激光笔照射某有色玻璃 | 出现丁达尔现象,说明该有色玻璃是胶体 |
| B | 向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和NaOH溶液洗涤、分液 | 得到较纯净的乙酸乙酯 |
| C | 向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 | 说明汽油中含有甲苯等苯的同系物 |
| D | AgCl饱和溶液中加入少量NaI溶液 | 产生黄色沉淀,说明Ksp(AgI)<Ksp(AgCl) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的溶液所用的容量瓶 |
| B、收集氨微喷泉实验所用的圆底烧瓶 |
| C、中和滴定实验中的酸式滴定管 |
| D、中和滴定实验中的锥形瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制作航天服的聚酯纤维和用于制光缆的光导纤维都是新型无机非金属材料 |
| B、使用太阳能、风能等清洁能源能减少PM2.5的污染 |
| C、水泥、玻璃、水晶饰物都是硅酸盐制品 |
| D、用浸泡过溴的四氯化碳溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
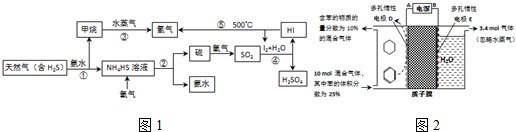
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com