
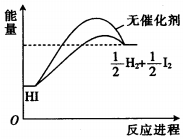
| A. | 加入催化剂,减小了反应的活化能 | |
| B. | 加入催化剂,可提高HI的平衡转化率 | |
| C. | 降低温度,HI的分解速率加快 | |
| D. | 反应物的总能量大于生成物的总能量 |
分析 由图象可知,反应物的总能量小于生成物的总能量,该反应为吸热反应;催化剂只影响活化能,从而影响反应速率,但不影响化学平衡,则不影响转化率;结合温度对反应速率的影响解答.
解答 解:A.加入催化剂,降低了反应的活化能,从而可加快反应速率,故A正确;
B.加入催化剂,只能影响反应速率,不影响化学平衡,则不会提高HI的平衡转化率,故B错误;
C.降低温度,反应速率减小,则HI的分解速率减小,故C错误;
D.根据图象可知,反应物的总能量小于生成物的总能量,该反应为吸热反应,故D错误;
故选A.
点评 本题考查反应热与焓变,题目难度中等,侧重考查化学平衡、化学反应能量的图象分析判断,注意催化剂改变速率不改变平衡的理解,试题培养了学生的分析能力及灵活应用能力.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:推断题
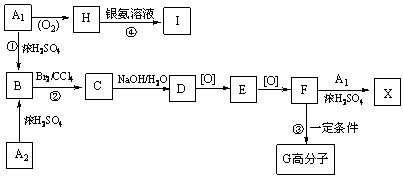
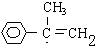 ; G
; G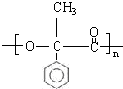 .反应C→D属于取代反应(填反应类型)
.反应C→D属于取代反应(填反应类型)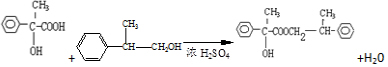 ;H→I反应的化学方程式
;H→I反应的化学方程式 .
.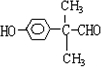 (任写一种即可).
(任写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol稀硫酸和1mol稀Ba(OH)2溶液完全中和所放出的热量为中和热 | |
| B. | 中和反应都是放热反应,盐类水解反应都是吸热反应 | |
| C. | 在101kPa时,1mol碳燃烧所放出的热量一定是碳的燃烧热 | |
| D. | 碳与二氧化碳的反应既是吸热反应,也是化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L 1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,24gNO2中所含的氧原子数为0.5NA | |
| C. | 常温常压下,11.2LCl2与足量Fe反应,转移电子数为NA | |
| D. | 1mol的羟基与1mol的氢氧根离子所含质子数均为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中,2mol SO2和1mol O2充分反应,生成SO3的分子数为2 NA | |
| B. | 1L1 mol•L-1 的(NH4)2SO4 溶液中含有的 NH4+数目为2NA | |
| C. | 足量的 MnO2与 100ml 12 mol•L-1的浓盐酸充分反应,转移的电子数目为 0.6 NA | |
| D. | 常温常压下,18 mL 水含有的分子数目约为 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com