
硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:
(1)操作Ⅰ具体为 、 、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是 (填字母代号)。
| A.灼烧过程中部分氧化铜被还原 |
| B.灼烧不充分,铜未被完全氧化 |
| C.氧化铜在加热过程中分解生成铜 |
| D.该条件下铜无法被氧气氧化 |
 NaNO3+NaNO2+H2O)。
NaNO3+NaNO2+H2O)。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:实验题
(13分)某研究性学习小组欲探究Na2CO3溶液与MgCl2溶液反应产生白色沉淀的成分,小组成员做如下实验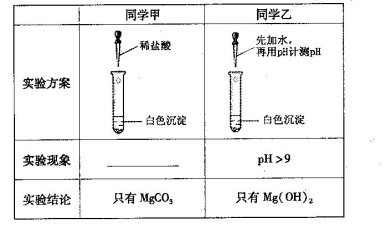
(1)若按所得的结论分析,甲观察到的实验现象是___________________________。
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥。同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点。
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3)___Ksp [Mg(OH)2](选填“<”或“>”),所以沉淀物未必是MgCO3。经查阅资料得知:该白色沉淀的组成应为Mgx(OH)y(CO3)z·nH2O。为确定沉
淀物的具体组成,他设计下图装置进行实验(所有夹持装置已省略)。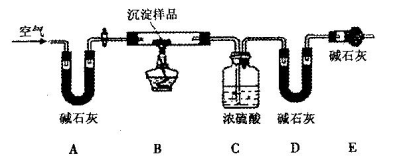
(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③________________________________________________________;
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量。
(5)装置E中碱石灰的作用是_________________________________________________。
三次实验所得数据如下:(部分数据已换算为相应的物质的量)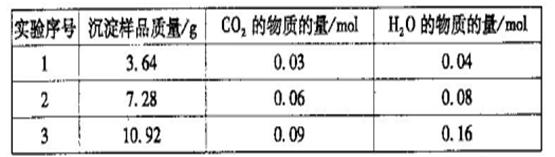
(6)分析实验数据可知,第_________组出现误差较大的数据,应舍去。由实验数据计算
得该白色沉淀物的组成为___________(选填序号)。
a.Mg2(OH)2CO3·3H2O b.Mg(OH)2(CO3)2·3H2O
c.Mg4(OH)2(CO3)3·3H2O d.Mg5(OH)4(CO3)3·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
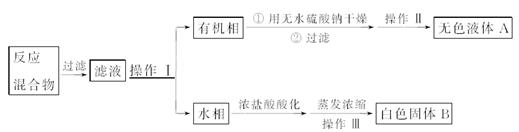
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下: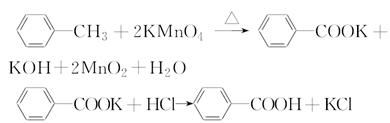
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866 g·cm-3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3 g和6.9 g。
【制备产品】 30.0 mL甲苯和25.0 mL 1 mol·L-1高锰酸钾溶液在80℃下反应30 min,装置如图所示:
(1)图中支管的作用是_______________________。
(2)冷凝管的作用是________;进水口为________(填“a”或“b”)。
(3)相对于用酒精灯直接加热,用沸水浴加热的优点是________;在本实验中,三颈烧瓶最合适的容积是________(填字母)。
| A.50 mL | B.100 mL | C.200 mL | D.250 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质。某同学在实验室中设计了用这种粗盐制备精盐的方案如下(用于沉淀的试剂稍过量):
请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):________。
| A.烧杯 | B.试管 | C.玻璃棒 | D.分液漏斗 E.漏斗 F.酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
苯乙醚是一种无色油状液体,熔点-30 ℃,沸点 172 ℃,不溶于水,易溶于醇和醚,广泛用于有机合成中间体及制造医药、染料等。实验合成的原理为:
主要实验步骤如下:
(Ⅰ)合成:在烧瓶中(装置如图)加入7.53 g苯酚、3.92 g NaOH和4 mL水,开动搅拌器,使固体全部溶解,加热反应器控制温度80~90 ℃之间,并用滴液漏斗慢慢滴加8.59 mL溴乙烷(沸点38.4 ℃),大约40 min滴加完毕,继续搅拌1 h,冷却至室温。
(Ⅱ)分离与提纯。
①加入适量的水(10~15 mL)使固体完全溶解,将液体转入分液漏斗中,分出水相;
②水相用8 mL乙醚萃取一次,与有机相合并;
③有机相用等体积饱和食盐水洗两次,分出水相,再将水相用6 mL乙醚萃取一次,与有机相合并;
④有机相用无水氯化钙干燥;
⑤先用水浴蒸出乙醚,然后常压蒸馏,收集148 ℃稳定的馏分得苯乙醚;
⑥称量产品质量3.69 g。
回答下列问题:
(1)用图示的滴液漏斗代替普通漏斗滴液,其优点是_______________________。
(2)合成时,开动搅拌器的目的是_______________________________。
(3)控制温度80~90 ℃可采用的方法是________________,两次用乙醚萃取的目的是________________________________________________________。
(4)蒸馏时最后温度稳定在148 ℃左右,其原因是_________________
_______________________________________________________。
(5)本次产率为12.4%,产率偏低的原因可能有__________________________
______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
草酸(H2C2O4)是一种弱酸,在工业中有重要作用。某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁,热水浸泡,经过滤得到溶液,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤沉淀备用,然后对生成的沉淀进行探究。
(1)草酸盐溶液呈弱碱性的原因是_____________________________________。
(2)该同学对生成的沉淀进行定性探究。
①提出合理假设。
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:___________________________________________________________。
②基于假设2,设计实验方案,进行实验。请在下表中写出实验步骤以及预期现象和结论。限选实验试剂:
1 mol·L-1 H2SO4、0.1 mol·L-1盐酸、0.01 mol·L-1 KMnO4溶液、澄清石灰水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入_________________________________ ________________________________ | _______________________________ _______________________________ 说明沉淀中有CaCO3 |
| 步骤2:_________________________ ________________________________ | ________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物。(夹持装置已略去,装置的气密性良好)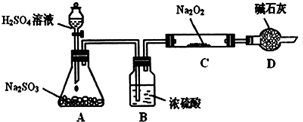
Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是:_________________________。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:_________________。
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:__________。 假设2:只有Na2SO4; 假设3:既有Na2SO3又有Na2SO4。
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:_____________________。
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如下实验:
得出结论:C中固体产物只有Na2SO4。该方案是否合理?答:__________。(填“是”或“否”)理由是______________________________。
(3)乙同学为证明假设3成立,设计如下实验。
实验步骤和结论为:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol?L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有_________;
③滴加适量的1mol?L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸亚锡(SuSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下: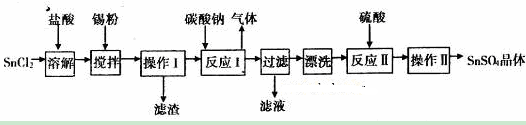
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
II.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)SnC12粉末需要加浓盐酸进行溶解,请用化学方程式说明原因___________________。
(2)在SnC12溶液中加入Sn粉的作用有两个:①调节溶液pH ②_________________。
(3)操作I中使用的玻璃仪器有___________________。
(4)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3,发生的反应为:SnCl2+ FeCl3= SnCl4+ FeCl2
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
滴定时,K2Cr2O7溶液应该装在____________(填“酸式”或“碱式”)滴定管中。
若取2.0g锡粉,经上述各步反应后,共用去0.100mol/L K2Cr2O7溶液40.00mL,锡粉中锡的质量分数是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
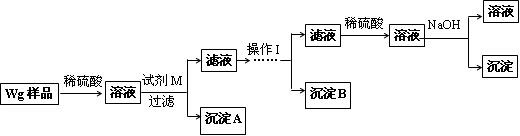
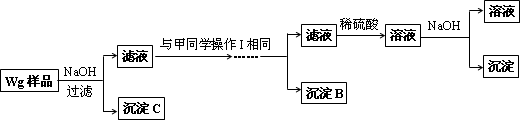
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在.
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O.
该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属; ②锌(Zn)可以与NaOH溶液反应生成H2; ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O; ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com