
下列性质的比较中,正确的是
A.熔点:Li<Na<K<Rb
B.沸点:NH3<PH3<AsH3<SbH3
C.热稳定性:SiH4>PH3>H2O>HF
D.酸性:H2SO3>H3PO4>HF>H2CO3>H2S>HClO
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
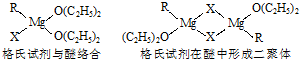
| ||
查看答案和解析>>
科目:高中化学 来源:期末题 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或物质性质的比较中正确的是
A.同周期元素的原子,半径越小越容易失去电子
B.所有主族元素都有正价,且最高正化合价数与它的族序数数值相等
C.酸性:H2CO3<H3PO4<H2SO4<HClO4
D.热稳定性:SiH4>NH3>H2O>HF
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com