
2015年10月,中国科学家屠呦呦获得了诺贝尔生理学奖,获奖理由是“因为发现青蒿素—一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素的分子式为C15H22O5,则关于青蒿素的说法中正确的是
A.青蒿素是一种氧化物
B.青蒿素的摩尔质量为282
C.56.4g青蒿素中所含氧原子数目为6.02×1023个
D.青蒿素中C、H、O元素的质量比为15:22:5
科目:高中化学 来源:2016-2017学年江苏省高一上期中化学试卷(解析版) 题型:选择题
下溶液中c(Cl-)与50mL 1mol/L 氯化铝溶液中的c(Cl-)相等的是
A.150 mL 1mol/L氯化钠溶液 B.5 mL 2mol/L 氯化铵溶液
C.150 mL 1mol/L氯化钾溶液 D.75 mL 1.5mol/L 氯化镁溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南郸城高级中学高二上第二次考试化学卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行 化学反应:CO2(g)+H2(g)
化学反应:CO2(g)+H2(g) CO(g)+H2O(g)达到平衡状态,其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)达到平衡状态,其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 10 | 1200 |
K[来 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ;再充入CO2气体,则平衡 移动(选“正向移动”、“逆向移动”或“不移动”),平衡常数K (选“增大”、“减小”或“不变”)。
(2)该反应的逆反应方向为 反应方向(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下的各物质平衡浓度符合:c(CO2)=c(CO),c(H2)=c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南郸城高级中学高二上第二次考试化学卷(解析版) 题型:选择题
500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g) N2O4(g),平衡后,向容器内再充入1molNO2,下列说法正确的
N2O4(g),平衡后,向容器内再充入1molNO2,下列说法正确的
A.容器内气体颜色先变深后变浅,最后比原来还要浅 B.平衡常数K增大
C.平衡向正反应方向移动 D.NO2的转化率变小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州贵阳花溪清华中学高一上月考一化学卷(解析版) 题型:实验题
欲用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸240ml。
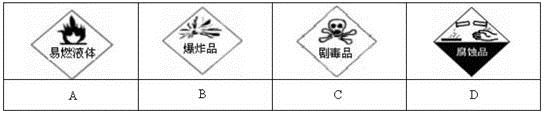
(1)在盛放浓硫酸的试剂瓶的标签上应印有下列警示标志中的____________。
(2)选用的主要仪器有:__________
①烧杯,②玻璃棒,③量筒,④胶头滴管,⑤____________。
(3)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至凹液面恰好与刻度线相切
D.稀释浓H2SO4
E.将冷却后的稀释液转入容量瓶
F.将蒸馏水注入容量瓶,直到液面距刻度线1-2cm处
G.用少量蒸馏水洗涤烧杯和玻璃棒2-3次,并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀,其操作正确的顺序依次为____________________________。
(4)简要回答下列问题:
①所需浓硫酸的体积为____________mL,如果实验室有10mL、20mL、50mL的量筒应选用____________mL的量筒最好
②下列操作使所配溶液浓度偏高的是__________
A.用水洗涤量取浓硫酸的量筒,并将洗涤液转入容量瓶中
B.用量筒来量取浓硫酸,读数时,俯视量筒
C.搅拌过程中有液体溅出
D.在转入容量瓶前烧杯中液体未冷却至室温
E.定容时,俯视刻度线
F.容量瓶用蒸馏水洗净后未经干燥马上用来配制溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州贵阳花溪清华中学高一上月考一化学卷(解析版) 题型:选择题
下列有关实验操作不能达到相应目的的是
|
|
|
|
A.排水法收集H2 | B.分离油和水 | C.实验室制取少量蒸馏水 | D.从饱和食盐水中提取NaCl晶体 |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江大庆实验中学高三上期中化学卷(解析版) 题型:填空题
亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g) 2ClNO(g) K3
2ClNO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)T℃时,2NO(g)+Cl2(g) 2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=____________;k=____________(注明单位)。
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
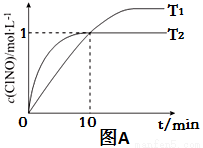
①温度为T1时,能作为该反应达到平衡的标志的有 ;
a.容器体积保持不变
b.容器压强保持不变
c.平衡常数K保持不变
d.气体颜色保持不变
e.v(ClNO)= v(NO)
f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=____________;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=____________(注明单位)。
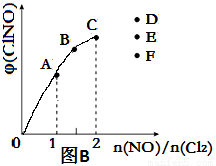
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是__________点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的_________点。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上期中化学试卷(解析版) 题型:实验题
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置 II 中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2→Na2S2O5

(1)装置 I 中产生气体的化学方程式为_________________。
(2)装置 III 用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(3)证明NaHSO3溶液中 HSO3?的电离程度大于水解程度,可采用的实验方法是___________(填序号)。
a.测定溶液的 pH
b.加入 Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是______________。
实验三 葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用 Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O→H2SO4+2HI)
①按上述方案实验,消耗标准 I2溶液 25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为____________g· L-1。
②在上述实验过程中,若有部分 HI 被空气氧化,则测得结果_____________(填“偏高”、 “偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江哈尔滨三中高三上期中化学试卷(解析版) 题型:选择题
下列关于电解质的说法正确的是
A.液态HCl不导电,所以HCl不是电解质
B.NH3溶于水形成的溶液能导电,所以NH3是电解质
C.稀硫酸能导电,所以稀硫酸是电解质
D.BaSO4在水溶液中难导电,但熔融状态下能导电,所以BaSO4是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com