0.02mol?L-1的HCN溶液与0.02mol?L-1的NaCN溶液等体积混合,已知混合溶液中C(CN-)<C(Na+),则下列关系中,正确的是( )
A.C(Na+)>C(CN-)>C( H+)>C(OH-)
B.C(HCN)+C(CN-)=0.04mol?L-1
C.C(Na+)+C(H+)=C(CN-)+C(OH-)
D.C(CN-)>C(HCN)
【答案】
分析:0.02mol?L
-1的HCN溶液与0.02mol?L
-1的NaCN溶液等体积混合,溶液中存在HCN的电离和CN
-的水解,混合溶液中C(CN
-)<C(Na
+),应有C(OH
-)>C( H
+),说明HCN的电离程度小于CN
-的水解程度,结合溶液的电荷守恒分析.
解答:解:HCN在溶液中存在电离平衡:HCN?H
++CN
-;NaCN在溶液中存在水解平衡:CN
-+H
2O?HCN+OH
-.因为c(Na
+)>c(CN
-),所以,CN
-的水解程度大于HCN的电离程度,溶液应显碱性,即c(OH
-)>c(H
+)、c(HCN)>c(CN
-).
A.由以上分析可知c(OH
-)>c(H
+),故A错误;
B.等体积混合后,溶液浓度为原来的

,则C(HCN)+C(CN
-)=0.02mol?L
-1,故B错误;
C.溶液存在电荷守恒,应为C(Na
+)+C(H
+)=C(CN
-)+C(OH
-),故C正确;
D.由以上分析可知c(HCN)>c(CN
-),故D错误.
故选C.
点评:本题考查溶液中离子的浓度的比较,侧重于学生分析、比较问题能力的考查,明确物质的化学式及水解、电离是解答本题的关键,注意把握题给信息,从电荷守恒、物料守恒的角度解答.

 ,则C(HCN)+C(CN-)=0.02mol?L-1,故B错误;
,则C(HCN)+C(CN-)=0.02mol?L-1,故B错误;

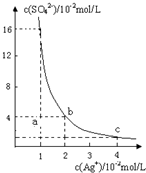 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示: