

分析 (1)要设计成原电池,该反应必须有电子得失或电子对转移;
(2)反应Cu+2AgNO3═Cu(NO3)2+2Ag中,Cu被氧化,应为原电池负极,电解质溶液为硝酸银,硝酸银被还原生成Ag,为正极反应,以此解答.
解答 解:(1)①反应为复分解反应,为放热反应,无电子的得失或电子对的转移,故不能设计成原电池;②氢气燃烧,为放热反应,反应中O2得到电子生成水,有电子的得失,故能设计成原电池,
故答案为:①②;②;
(2)①利用反应Cu+2AgNO3═Cu(NO3)2+2Ag设计原电池时,根据反应可知,Cu为负极,则正极可以是活泼性不如Cu的金属,也可以是碳棒,电解质溶液应为AgNO3,反应装置为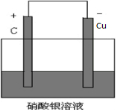 ,故答案为:
,故答案为: ;
;
②正极发生2Ag++2e-=2Ag,析出银,现象为电极析出银白色金属,故答案为:析出银白色金属;
③正极发生2Ag++2e-=2Ag,若反应过程中有0.01mol电子发生转移,则析出0.01molAg,质量为1.08g,故答案为:1.08.
点评 本题考查原电池设计,侧重考查学生知识运用能力,难点是根据电池反应式确定正负极材料及电解质溶液,根据元素化合价变化确定正负极及电解质溶液,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

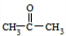 +2H2O;
+2H2O;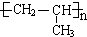 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是直线形结构 | |
| B. | 中心原子都采取sp3杂化轨道 | |
| C. | SO2中S原子和SO3中S原子上都没有孤对电子 | |
| D. | SO2为V形结构,SO3为平面三角形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
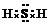 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子及其简单阴离子的核外电子层数都等于该元素所在的周期数 | |
| B. | 原子最外层电子数都等于其所在的族序数 | |
| C. | 元素周期表从ⅢB到ⅡB族共8个纵行,全都是金属元素 | |
| D. | 同周期表中ⅦA族元素的原子半径较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | E | F | H | I | K | |||
| 3 | B | C | D | G | J |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度,当A质量不变时,说明该反应已达平衡 | |
| B. | 若D为气体,再加入1mol A,平衡正向移动,A的转化率增大 | |
| C. | 升高温度,正反应的平衡常数增大 | |
| D. | 若D为固体,再加入1mol A,平衡不移动,A在混合气体中的百分含量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com