
| A、20℃时,饱和KCl溶液与等质量的水混合后物质的量浓度大于2.0mol?L-1 |
| B、20℃时,将29.8 gKCl溶于87.6g水中可得饱和溶液 |
| C、20℃时,密度小于1.174g?cm-3的KCl溶液是不饱和溶液 |
| D、将此溶液蒸发部分水,再恢复到20℃时,溶液中各离子的浓度不变 |
| 298 |
| 1174 |
| 29.8g |
| 29.8g+87.6g |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| 密闭容器体积/L | 甲 | 乙 | 丙 | 丁 | |
| 2 | 2 | 2 | 1 | ||
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A、甲中反应的平衡常数小于乙 |
| B、该温度下,甲和乙中反应的平衡常数K均为400 |
| C、SO2的平衡转化率:α1>α2=α3 |
| D、容器中SO3的物质的量浓度:丙>甲=丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种都是极性分子 |
| B、两种都是非极性分子 |
| C、CH4是极性分子,H2O是非极性分子 |
| D、H2O是极性分子,CH4是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积相等时质量一定相等 |
| B、电子数相等时具有相等的原子数 |
| C、同温同压下质子数相等则体积相等 |
| D、质量相等时具有相等的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20% | B、40% |
| C、50% | D、60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加水中氧气的含量 |
| B、提高水温 |
| C、除去次氯酸 |
| D、利用紫外线杀菌 |
| E、利用紫外线杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2L氮气所含的原子数目为NA |
| B、NA个甲烷分子和1mol甲烷的质量相等 |
| C、2L 1mol?L-1的盐酸中所含氯化氢分子数约为2NA |
| D、常温下,0.05mol CO和SO2混合气体中所含氧原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
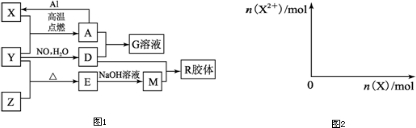
查看答案和解析>>
科目:高中化学 来源: 题型:

| H2O2 |
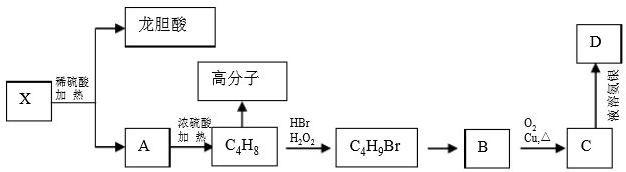
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com