
 ;
; ;
;分析 (1)用短线“-”代替共用电子对甲烷结构式;
(2)乙烯分子中碳碳以双键相连,碳剩余价键被H饱和,由此写出电子式;
(3)异丙基为丙烷失去之间碳原子上的应该H原子形成的,其结构简式为:-CH(CH3)2.
解答 解:(1)甲烷分子式为CH4,碳原子与氢原子之间形成1对共用电子对,结构式为 ,故答案为:
,故答案为: ;
;
(2)乙烯分子中碳碳以双键相连,碳剩余价键被H饱和,由此写出电子式为: ,故答案为:
,故答案为: ;
;
(3)-OH为羟基,异丙基为丙烷失去之间碳原子上的应该H原子形成的,其结构简式为:-CH(CH3)2 ,醛基的结构简式为-CHO,故答案为:羟基;-CH(CH3)2;-CHO.
点评 本题考查常见有机物的基团、官能团的结构名称、结构式等的考查,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
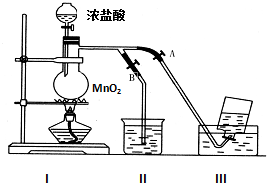 如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在试管中加入2mL10%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡,再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基 | |
| B. | 将无水乙醇加热至170℃时,可以制得乙烯 | |
| C. | 用氢氧化钠溶液清洗盛过苯酚的试管 | |
| D. | 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;G的结构简式HCOOCH3;
;G的结构简式HCOOCH3; .写出D与C反应生成A的化学方程式CH3OH+
.写出D与C反应生成A的化学方程式CH3OH+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Al3+、NO3-、SiO32- | B. | Ca2+、Fe3+、Cl-、CO32- | ||
| C. | Na+、SO42-、OH-、NO3- | D. | NH4+、OH-、Cl-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
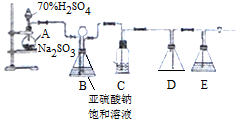

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com