
若溶液中由水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1,满足此条件的溶液中一定可以大量共存的离子组是( )
|
| A. | Al3+ Na+NO3﹣ Cl﹣ | B. | K+ Na+Cl﹣ NO3﹣ |
|
| C. | K+ Na+ Cl﹣AlO2﹣ | D. | K+ NH4+ SO42﹣NO3﹣ |
| 离子共存问题.. | |
| 专题: | 离子反应专题. |
| 分析: | 由水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1,该溶液 为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子, A.碱性溶液中,铝离子与氢氧根离子发生反应生成氢氧化铝沉淀; B.K+、Na+、Cl﹣、NO3﹣离子之间不发生反应,都不与氢离子和氢氧根离子反应; C.酸性溶液中,偏铝酸根与氢离子反应生成氢氧化铝沉淀; D.铵根离子与氢氧根离子反应生成弱碱一水合氨. |
| 解答: | 解:若溶液中由水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1,该溶液中存在大量氢离子或氢氧根离子, A.碱性溶液中,Al3+与氢氧根离子反应,在溶液中不能大量共存,故A错误; B.K+、Na+、Cl﹣、NO3﹣离子之间不反应,且都不与氢离子或氢氧根离子反应,在溶液中能够大量共存,故B正确; C.酸性溶液中,AlO2﹣与氢离子反应,在溶液中不能大量共存,故C错误; D.碱性溶液中,NH4+与氢氧根离子反应,在溶液中不能大量共存,故D错误; 故选B. |
| 点评: | 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH﹣;是“可能”共存,还是“一定”共存等. |


科目:高中化学 来源: 题型:
乙醇在实际生产生活中有广泛用途。
(1)下列选项中属于乙醇作为燃料的优点的是________。
①燃烧时发生氧化反应
②充分燃烧的产物不污染环境
③乙醇是一种可再生能源
④燃烧时放出大量热量
A.①②③ B.①②④
C.①③④ D.②③④
(2)在焊接铜漆包线的线头时,通常先把线头放在火上烧一下除去漆层,并立即在酒精中蘸一下再进行焊接操作,这是因为(用反应方程式表示):
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中不属于水解反应的是( )
A.纤维素在稀硫酸作用下转化为葡萄糖
B.葡萄糖在酒化酶作用下转化为乙醇和二氧化碳
C.乙酸乙酯在氢氧化钠溶液中加热反应
D.淀粉在一定条件下转化为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ、已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反
应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
Ⅱ、某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定
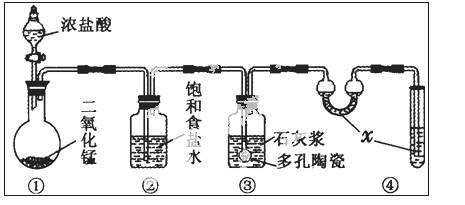
(1)装置④中的x试剂为 。
(2)装置③中发生反应的化学方程式为 。该反应是放热反应,反应温度较高时有副反应发生。改进该实验装置以减少副反应发生的方法是 _______________。
(3)测定漂白粉有效成分的质量分数
称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I- = 3Cl-+ IO3- IO3- + 5I- + 3H2O = 6OH- + 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为 。若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将 (填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+ ),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将 (填“偏高”、或“偏低”或“不变”)。
(2)氨气常用 检验,现象是 。
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关二氧化硫的说法中,错误的是( )
|
| A. | 二氧化硫的水溶液能使紫色石蕊试液变红,说明它能和水反应生成H2SO3 |
|
| B. | 二氧化硫能漂白某些物质,说明它具有氧化性 |
|
| C. | 将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色,说明二氧化硫具有还原性 |
|
| D. | 实验室可用浓硫酸干燥二氧化硫气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气.下列说法正确的是( )
|
| A. | 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量小 |
|
| B. | 两烧杯中参加反应的锌等量 |
|
| C. | 甲烧杯中的酸过量 |
|
| D. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硒(Se)被科学家称之为人体微量元素中的“防癌之王”,同时也是“心脏的守护神”“肝病的天敌”,对人体具有良好的保健作用。已知硒为第四周期、与氧同一族,根据它在周期表中的位置推测,硒不可能具有的性质为( )
A.硒也有两种氧化物,分别为SeO2和SeO3两种
B.硒化氢属于共价化合物,比硫化氢稳定
C.硒化氢的水溶液显弱酸性
D.硒单质的非金属性比氧弱
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。
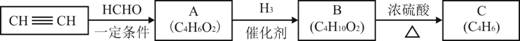
已知:

(1)A分子中的官能团名称是_______、_______。
(2)A的一种同分异构体属于乙酸酯,其结构简式是________________
(3)B转化为C的化学方程式是________________________________________,其反应类型是_______。
II.用烃C或苯合成PMLA的路线如下。
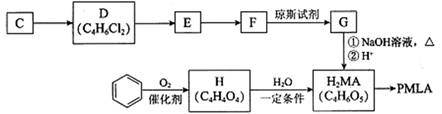
已知:

(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式结构简式是________________
(5)E的结构简式是________________
(6)G与NaOH溶液在加热条件下反应的化学方程式是_________________________
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种)________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com