
【题目】往含有H+、Fe2+、Cu2+、Ag+四种离子的溶液中加入足量镁粉,最先得到的还原产物是( )
A.H2
B.Fe
C.Cu
D.Ag
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
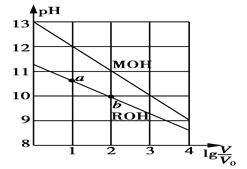
A. MOH为弱碱,ROH为强碱
B. ROH的电离程度:a点大于b点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol 铁和高温水蒸气完全反应转移的电子数为3NA
B. 常温常压下,1mol 氦气含有的原子数为NA
C. 标准状况下,11. 2 L 乙醇含有的分子数目为0. 5NA
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是( )
A. 用10mL量筒量取7.13mL稀盐酸
B. 用pH计测得某稀盐酸的pH为1.54
C. 用碱式滴定管量取烧碱溶液20.3 mL
D. 用托盘天平称得某物质的质量为13.15g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用NaOH溶液吸收尾气中的H2S气体,再将得到的Na2S溶液进行电解制得NaOH溶液,以实现NaOH的循环利用。电解装置如图所示,电极材料均为石墨,ab、cd均为离子交换膜。下列叙述不正确的是
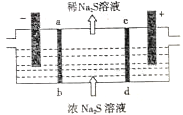
A. ab表示阳离子交换膜,cd表示阴离子交换膜
B. 阳极的电极反应式为S2--2e-==S↓,阳极区有淡黄色沉淀产生
C. 阴极的电极反应式为2H2O-4e-==O2↑+4H+,阴极区溶液pH降低
D. 当电路中转移1mol电子时,会有11.2L(标准状况)的气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、前20号元素A、B、C、D,其中A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)C在周期表中的位置__________________________;
(2)B 元素的原子结构示意图____________________________;
(3)化合物D2C的电子式______________________________;
(4)B最简单气态氢化物与最简单的有机物的稳定性强弱关系(用相应的化学式表示):____ > ____;
(5)C、D离子的半径大小关系为C______D (填:>、=、<);
(6)B的氢化物与B的最高价氧化物对应水化物反应的生成物中含有的的化学键有__________填选项)。
A、只含离子键 B、既有离子键又有共价健
C、只含有共价键 D、既有极性共价键又有非极性共价键
Ⅱ、利用下图装置来验证同主族元素非金属性的变化规律:

(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C中溶液现象是:___________,即可证明。干燥管D的作用是___________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_________________溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中______________的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,因此应在B、D之间增加一个盛有足量__________的洗气装置(选填下列字母)
A.浓盐酸 B.浓NaOH溶液 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC-CHO)化学性质活泼,是纺织工业中常用的一种有机原料,能增加棉花、尼龙等纤维的防缩性和防皱性。其工业生产方法主要是乙二醇(HOCH2CH2OH)气相催化氧化法和乙醛液相硝酸氧化法。请回答下列相关问题:
(1)乙二醇气相催化氧化法
以乙二醇、氧气为原料,在催化剂存在的条件下,250℃左右开始缓慢进行,生成乙二醛和副产物乙醇酸[CH2(OH)COOH]的反应方程式:
I.HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)△H1
OHC-CHO(g)+2H2O(g)△H1
II.HOCH2CH2OH(g)+O2(g) ![]() CH2(OH)COOH(g)+H2O(g)△H2
CH2(OH)COOH(g)+H2O(g)△H2
已知反应I中相关化学键键能数据如下:
化学键 | C-H | C-O | H-O | O==O | C==O | C-C |
E/kJ·mol-1 | 413 | 343 | 465 | 498 | 728 | 332 |
①△H1=_____kJ/mol,反应I的化学平衡常数表达式为K=________。
②欲提高I的平衡产率,可以采取的措施是______(填标号)。
A.升高温度 B.增大压强 C.降低温度 D.减小压强
③提高乙二醛反应选择性的关键因素是_________________________。
④保持温度和容积不变,下列描述能说明反应I达到平衡状态的是________(填标号)。
A.v正(O2)=2v逆(H2O)
B.混合气体的压强不再随时间变化而变化
C.混合气体的密度不再发生变化
D.乙二醇与OHC-CHO的物质的量之比为1:1
E.混合气体中乙二醛的体积分数不再发生变化
(2)乙醛(CH3CHO)液相硝酸氧化法
11.0g40%的乙醛溶液和40%的硝酸,按一定比例投入氧化反应釜内,在Cu(NO3)2催化下,控制温度在38~40℃时,反应10h,再通过萃取等操作除去乙醛、硝酸等,最后经减压浓缩得4.35g40%乙二醛溶液。
①用稀硝酸氧化乙醛制取乙二醛时,有N2O产生。其化学方程式为______________________。
②利用上面数据,计算乙二醛的产率为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL、0.1mol/L的NaOH溶液中加入0.1mol/L的HA溶液,溶液pH的变化曲线如图所示。下列说法正确的是( )
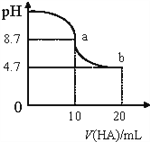
A. pH=7时,c(Na+)= c(A-)+c(HA)
B. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
C. b点所示溶液中:c(A-)>c(HA)
D. a、b两点所示溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0. 10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f=![]() ]与混合液pH的关系如图所示。下列说法正确的是
]与混合液pH的关系如图所示。下列说法正确的是
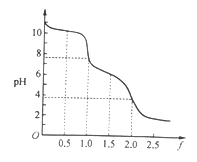
A. f=0时,溶液中:c(Na+)=2c(CO32-)
B. f=0.5时,溶液中:c(HCO3-)>c(CO32-)
C. f= 1时,溶液中:c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-)+c(OH-)
D. f=2时,溶液中:1/2c(Na+)=c(CO32-)+c( HCO3-)+c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com