
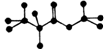
| A. | 该物质在酸性条件下水解生成乙酸 | |
| B. | 该物质含有双键,能跟氢气发生加成反应 | |
| C. | 该物质属于酯类 | |
| D. | 分子式为C3H8O2 |
科目:高中化学 来源: 题型:解答题
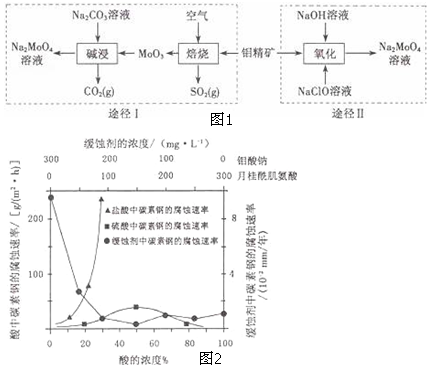
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 食盐中添加碘酸钾(KIO3)加工碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
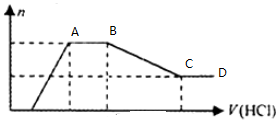
| A. | 溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl- | |
| B. | OA段参加反应的阴离子的物质的量之比为2:1或1:2 | |
| C. | AB段一定生成了气体 | |
| D. | BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是用来描述物质所含微粒数目多少的基本物理量 | |
| B. | 1 mol氯约含有 6.02×1023个微粒 | |
| C. | 水的摩尔质量是它的相对分子质量 | |
| D. | 1 cm3铁所含有的铁原子数是$\frac{ρ•{N}_{A}}{56}$( ρ是铁的密度,单位为 g/cm3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
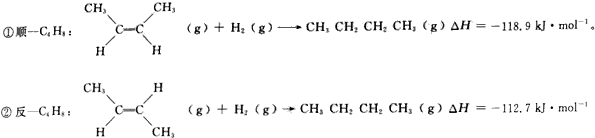


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前 5min 的平均速率为 v (SO2)=0.08mol•L-1•min-1 | |
| B. | 保持温度不变,向平衡后的容器中再充入 1molSO2和 0.5molO2时,v (正)>v (逆) | |
| C. | 该温度,反应的平衡常数为 11.25L•mol-1 | |
| D. | 相同温度下,起始时向容器中充入 1.5mol SO3,达平衡时 SO3的转化率为 40% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com