
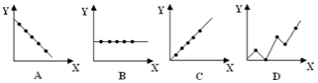
| A. | 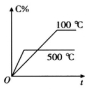 | B. | 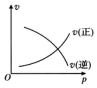 | C. | 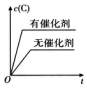 | D. | 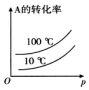 |
分析 A、先拐先平,温度高,反应是放热反应,升温平衡逆向进行;
B、反应是气体体积减小的反应,压强增大速率增大,正反应速率增大的多;
C、催化剂改变反应速率不能改变化学平衡;
D、压强不变,温度越高平衡逆向进行,A转化率减小,温度一定,压强越大反应正向进行,A转化率增大.
解答 解:A、先拐先平,温度高,反应是放热反应,升温平衡逆向进行,C体积分数减小,图象符合,故A正确;
B、反应是气体体积减小的反应,压强增大速率增大,正反应速率增大的多,图象中逆反应速率减小是错误,故B错误;
C、催化剂改变反应速率不能改变化学平衡,平衡后C的浓度不变,故C错误;
D、压强不变,温度越高平衡逆向进行,A转化率减小,图象中转化率曲线错误,温度一定,压强越大反应正向进行,A转化率增大,故D错误;
故选A.
点评 本题考查了图象变化趋势分析,化学平衡影响因素的分析应用,化学平衡移动原理的理解应用是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15NA | |
| B. | 0.1mol•L-1(NH4)2SO4溶液与0.2mol•L-1NH4Cl溶液中的NH4+数目相同 | |
| C. | H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 含0.1molNH4HSO4的溶液中,阳离子数目略大于0.21NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-一定存在 | |
| B. | CO32-和SO42-一定存在,且二者的个数比为1:2 | |
| C. | Zn2+和Ca2+一定不存在 | |
| D. | 100mL溶液中K+的质量不小于2.34g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
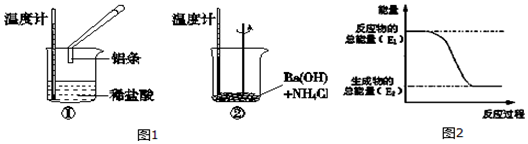

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
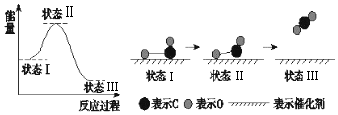
| A. | 状态Ⅰ→状态Ⅲ是放热过程 | |
| B. | 该过程中,CO先断键形成C和O,再生成CO2 | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O2反应,生成了CO2 | |
| D. | 状态Ⅰ→状态Ⅱ表示催化剂对反应没有起作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:金刚石>干冰 | B. | 离子半径:O2->Na+ | ||
| C. | 碱性:KOH>Al(OH)3 | D. | 稳定性:SiH4>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中能检测到Fe2+ | B. | 溶液中能检测到I2 | ||
| C. | 溶液中能检测到Fe3+ | D. | 溶液中能检测到Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com