
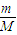 及Fe+H2SO4═FeSO4+H2↑可计算各生成物的物质的量,再利用V=nVm、c=
及Fe+H2SO4═FeSO4+H2↑可计算各生成物的物质的量,再利用V=nVm、c=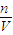 、w%=
、w%=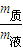 来计算.
来计算.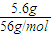 =0.1mol,
=0.1mol,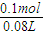 =1.25mol/L,
=1.25mol/L,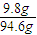 ×100%=10.4%,
×100%=10.4%,

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省湛江市徐闻实验中学高一(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com