
分析 (1)纯碱为强碱弱酸盐,CO32-水解呈碱性,水解离子方程式为CO32-+H2O?HCO3-+OH-;
(2)根据AlCl3属于强酸弱碱盐,在溶液中存在水解平衡,从平衡移动的角度分析并解答该题;
解答 解:(1)纯碱为强碱弱酸盐,CO32-水解呈碱性,水解离子方程式为CO32-+H2O?HCO3-+OH-,加入酚酞溶液变红色,
故答案为:溶液变红;CO32-+H2O?HCO3-+OH-;
(2)氯化铝为强酸弱碱盐,Al3+发生水解,水解的方程式为Al3++3H2O?Al(OH)3+3H+,水解后溶液呈酸性,蒸干和灼烧过程中,HCl挥发,Al(OH)3不稳定,灼烧时分解生成Al2O3,
故答案为:Al2O3,因为AlCl3是挥发性酸所形成的铝盐,加热促进AlCl3水解,以致完全得到Al(OH)3,HCl则挥发掉:AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+3HCl↑,高温下,可使Al(OH)3分解,2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,固体产物为Al2O3.
点评 本题是基础性试题的考查,试题难易适中,基础性强.该题的关键是明确盐类水解的原理,然后结合提高信息灵活运用即可.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:解答题
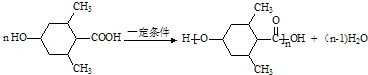
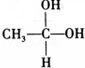 →CH3-CHO+H2O
→CH3-CHO+H2O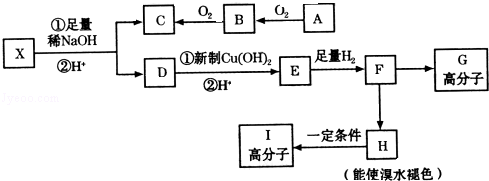
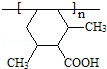 .
.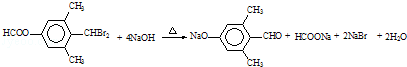 .
. .
.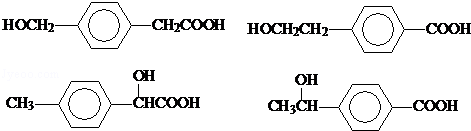 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
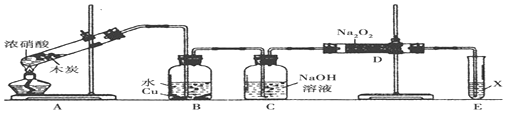
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 第一步需选用仪器①、②和⑨,仪器①的名称叫坩埚 | |
| B. | 第二步用浓硝酸溶解茶叶灰,可能将Fe2+氧化成Fe3+ | |
| C. | 要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 | |
| D. | 第四步,用试剂⑧检验滤液中的Fe3+,溶液中生成血红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
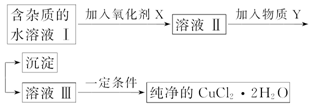
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
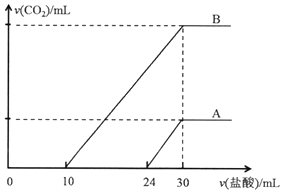 向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.
向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com