
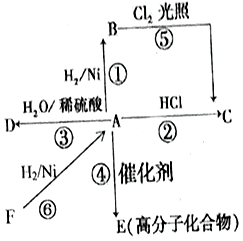
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.分析 烃A的产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂,故A为CH2=CH2,乙烯与氢气发生加成反应生成B,B为CH3CH3,乙烯与HCl发生加成反应生成C,C为CH3CH2Cl,乙烯与水发生加成反应生成D,D为CH3CH2OH,乙烯发生加聚反应生成高分子化合物E,E是 ,F与氢气加成得乙烯,所以F为CH≡CH,据此答题.
,F与氢气加成得乙烯,所以F为CH≡CH,据此答题.
解答 解:(1)根据上面的分析可知,A为CH2=CH2,D为CH3CH2OH,
故答案为:CH2=CH2;CH3CH2OH;
(2)根据上面的分析可知,反应②的化学方程式 CH2═CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl,反应类型为加成反应,反应⑤的化学方程式 CH3-CH3+Cl2$\stackrel{光照}{→}$CH3-CH2Cl+HCl,
故答案为:加成;CH2═CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl; CH3-CH3+Cl2$\stackrel{光照}{→}$CH3-CH2Cl+HCl;
(3)F为CH≡CH,实验室中制取F的化学方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
点评 本题考查有机物的推断,比较基础,旨在考查学生对基础知识的掌握,注意基础知识的全面掌握.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2SO4和 NaCl 的物质的量之比为 1:3 | |
| B. | 溶液中一定有 1molNa2SO4 和 3molNaCl | |
| C. | 所带电荷数 SO42-是 Na+的 $\frac{3}{5}$ 倍 | |
| D. | SO42-与 Cl-的物质的量之和等于 Na+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO32- K+ Fe3+ Cl- | B. | NO3- K+ Mg2+ SO42- | ||
| C. | ClO- Na+ HCO3- SCN- | D. | SO42- Mg2+ Cl- H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
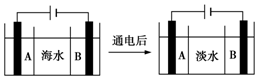 水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯(甲苯)KMnO4(酸化),NaOH溶液分液 | B. | 乙烷(乙烯)酸性KMnO4(溶液洗气 | ||
| C. | 乙酸乙酯(乙酸)KOH溶液分液 | D. | 苯(苯酚)浓Br2水过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液,正极为2NiO(OH)、负极为Cd | |
| B. | 放电时,每通过2 mol电子,负极质量减轻112 g | |
| C. | 放电时,电子从正极流向电源的负极 | |
| D. | 充电时,Cd极板应与外电源的正极相接 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com