
【题目】一定条件下,在容积固定的某密闭容器中发生反应N2+3H2![]() 2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
A. 用NH3表示的化学反应速率为0.1 mol·L-1·s-1
B. 使用合适的催化剂,可以加快该反应的速率
C. 增加H2的浓度或降低温度都会加快该反应速率
D. 反应足够长时间,N2、H2中至少有一种物质浓度降为零
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构简式为: 。
(2)写出B、D化合物中官能团的名称:B ;D ;
(3)写出反应的化学方程式
①: 反应类型:
②: 反应类型:
③: 反应类型:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下。下列说法正确的是( )
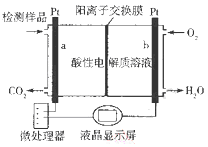
A. 该装置为电能转化为化学能的装置
B. a电极发生的电极反应为CH3OH + H2O - 6e-═ CO2↑ + 6H+
C. 当电路中有1 mol e-转移时,正极区n(H+)增加1 mol
D. 将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO![]() 、CO
、CO![]() 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液体积变化的图像如图所示,下列说法正确的是( )
等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液体积变化的图像如图所示,下列说法正确的是( )
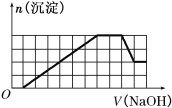
A.原溶液中含有的阳离子是H+、Fe3+、Al3+
B.原溶液中一定含有SO![]() 和Na+
和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
D.反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池将是21世纪获得电能的重要途径。近几年开发的丁烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

请回答下列问题:
(1)Pt(b)电极是电池的________极,电极反应式为_____________________________;Pt(a)电极发生________反应(填“氧化”或“还原”),电极反应式为____________。
(2)若电解质溶液改为KOH溶液,Pt(b)电极的电极反应式为_____________;Pt(a)电极的电极反应式为_____________________________________________________________。
(3)如果该电池工作时电路中通过1.2 mol电子,则消耗掉O2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我们复习了常见的几种金属:Na、Mg、Al、Fe、Cu。请结合我们所学知识回答下列问题:
(1)钠原子核外电子有________运动状态,其化合物Na2O2可用作________________。
(2)镁在二氧化碳中点燃的化学方程式为______________________________。
(3)铝在元素周期表中位于______________________________。
(4)除去Fe中的杂质Al所发生反应的离子方程式为_____________________________。
(5)上面几种金属中可用热还原法冶炼的是______________________________。
(6)铜的价电子排布式为3d104s1而不是3d94s2是依据_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮等单质和化合物的反应有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H= -76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图如下:
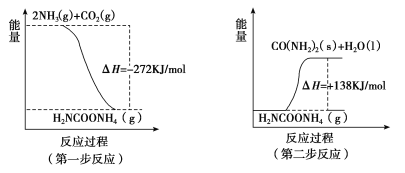
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为____________________。
(3)氨气在纯氧中燃烧,生成一种单质和水,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
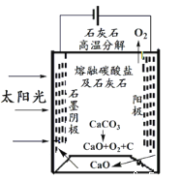
①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能
b、太阳能转化为电能
c、太阳能转化为化学能
d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-,则阳极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:①SiO2 + 2C![]() Si + 2CO
Si + 2CO
精炼硅:②Si + 3HCl![]() SiHCl3 + H2
SiHCl3 + H2
③SiHCl3 + H2![]() Si + 3HCl
Si + 3HCl
化学反应与能量变化如图所示,回答下列问题:
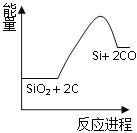
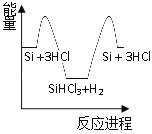
(1)反应①是_________反应(填“吸热”或“放热”),反应②是_________反应(填“吸热”或“放热”)。
(2)反应③破坏反应物中的化学键所吸收的能量_________形成生成物中化学键所放出的能量(填“大于”或“小于”)。
(3)研究物质变化时,人们可以从不同角度、不同层面来认识物质变化时所引起的化学键及能量变化。据此判断下列说法错误的是_________(双选)。
A.金属钠和氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B.等量的硫蒸气和硫固体分别完全燃烧,前者放出的能量多
C.氮气分子内部存在着很强的共价键,故通常状况下氮气的化学性质很活泼
D.由石墨制取金刚石是吸热反应,可知金刚石比石墨稳定
E.由放热反应H2 + Cl2 ==== 2HCl来说,断裂1mol H—H键和1molCl—Cl键所吸收的能量小于形成2molH—Cl键所放出的能量
(4)在研究化学反应中的能量变化时,我们通常做下面的实验:
在一个小烧杯里,加入20g已经研磨成粉末的氢氧化钡晶体【Ba(OH)2.8H2O】,将小烧杯放在事先已滴有3—4滴水的玻璃片上,然后向烧杯中加入约10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。写出实验过程中发生反应的化学方程式_________,该反应中反应物总能量_________生成物的总能量(填“大于”或“小于”),实验过程中立即用玻璃棒迅速搅拌的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯的球棍模型如图所示(图中球与球之间连线表示 单键或双键)。
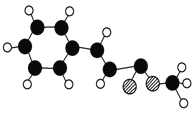
(1)肉桂酸甲酯的分子式为 。
(2)肉桂酸甲酯能发生的反应类型是 (填字母代号)。
A.加成反应 B.酯化反应 C.消去反应 d 取代反应
(3)肉桂酸甲酯与NaOH溶液反应生成的相对分子质量较小的有机物的结 构简式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com