
| A. | Fe304与稀硝酸反应的离子方程式为:3Fe3O4+28H++N03一═9Fe3++NO↑+14H20 | |
| B. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++C02↑+3H2O | |
| C. | 向NH4Al(S04)2溶液中滴人Ba(OH)2溶液恰好使S042-完全沉淀:2Ba2-+NH4++Al3++2SO42-+40H-═Al(OH)3↓+NH3•H20+2BaSO4↓ | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++OH-+HC03-═CaCO3↓+H2O |
分析 A.四氧化三铁与硝酸反应生成硝酸铁和一氧化氮和水;
B.碱式碳酸铜与稀硫酸反应生成硫酸铜、二氧化碳和水;
C.向NH4Al(S04)2溶液中滴人Ba(OH)2溶液恰好使S042-完全沉淀,反应生成氢氧化铝、一水合氨和硫酸钡;
D.氢氧化钙少量反应生成碳酸钙、碳酸钠和水;
解答 解:A.Fe304与稀硝酸反应的离子方程式为:3Fe3O4+28H++N03一═9Fe3++NO↑+14H20,故A正确;
B.碱式碳酸铜与稀硫酸反应生成硫酸铜、二氧化碳和水,离子方程式:4H++Cu2(OH)2CO3═2Cu2++C02↑+3H2O,故B正确;
C.向NH4Al(S04)2溶液中滴人Ba(OH)2溶液恰好使S042-完全沉淀,反应生成氢氧化铝、一水合氨和硫酸钡,离子方程式:2Ba2-+NH4++Al3++2SO42-+40H-═Al(OH)3↓+NH3•H20+2BaSO4↓,故C正确;
D.少量氢氧化钙溶液与碳酸氢钠溶液混合,离子方程式:Ca2++2OH-+2HC03-═CaCO3↓+2H2O+CO32-,故D错误;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,选项C为易错选项.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g),△H=-285.8 kJ/mol | |
| B. | 中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 | |
| C. | 稀氨水中部分粒子的浓度大小关系:c(NH3•H2O)>c(OH-)>c(NH${\;}_{4}^{+}$)>c(H+) | |
| D. | 1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)═c(Y-)+c(HY),则HX为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
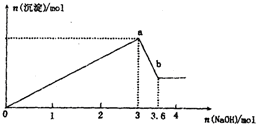 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
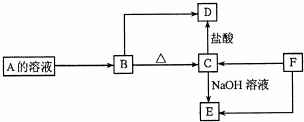
 金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.
金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸除去水垢中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 铜和浓硝酸反应:Cu+4H++2NO${\;}_{3}^{-}$═Cu2++2NO2↑+2H2O | |
| C. | 向氨水中通入过量SO2:2NH3•H2O+SO2═2NH${\;}_{4}^{+}$+SO${\;}_{3}^{2-}$+H2O | |
| D. | H2SO4溶液和Ba(OH)2溶液:H++SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验装置图 | 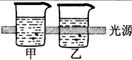 |  | 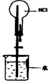 | 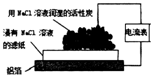 |
| 实验现象 | 乙装置中有亮光通路,甲装置无明显现象 | 关闭止水夹,捂住圆底烧瓶,导管中水柱上升后静止不动 | 打开止水夹,挤压胶头滴管中的水,有喷泉产生 | 电流表指针发生偏转 |
| 实验结论 | 甲装置中分散系不是胶体,乙装置中分散系为胶体 | 该装置气密性良好 | HCl易溶于水 | 电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1K2SO4溶液中含有钾离子数为2NA | |
| B. | 0.1mol铁与0.1mol氯气点燃完全反应,转移电子数为0.3NA | |
| C. | 常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA | |
| D. | 1L1mol•L-1氨水中,含有的NH3与NH3•H20分子的总数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com