
| A. | 原子半径X>Y>Z | B. | 气态氢化物稳定性 HX<HY<HZ | ||
| C. | 非金属性X>Y>Z | D. | 阴离子的还原性X->Y->Z- |
分析 同主族元素从上到下元素的非金属性逐渐减弱,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,已知最高价氧化物对应水化物的酸性:HXO4>HYO4>HZO4,则非金属性X>Y>Z,以此判断元素对应单质、化合物的性质.
解答 解:同主族元素对应最高价氧化物对应水化物的酸性:HXO4>HYO4>HZO4,则非金属性X>Y>Z,则
A.同主族元素从上到下元素的非金属性逐渐减弱,原子半径逐渐增大,则原子半径:X<Y<Z,故A错误;
B.非金属性越强,则其气态氢化物的稳定性越强,非金属性X>Y>Z,则气态氢化物稳定性 HX>HY>HZ,故B错误;
C.同主族元素对应最高价氧化物对应水化物的酸性:HXO4>HYO4>HZO4,则非金属性X>Y>Z,故C正确;
D.非金属性越强,则其阴离子的还原性越弱,非金属性X>Y>Z,则阴离子的还原性X-<Y-<Z-,故D错误.
故选C.
点评 本题考查同主族元素的性质的递变规律,为高考常见题型,题目难度不大,本题注意把握元素周期律的递变规律以及元素对应的单质、化合物的性质.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:解答题
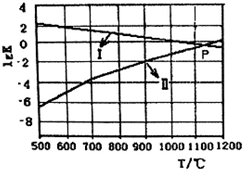 一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:
一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | a+1=d-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,离子键,共价键;
,离子键,共价键;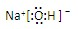 ,离子键,共价键;
,离子键,共价键; ;共价键;
;共价键; ,共价键,离子键.
,共价键,离子键.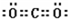 ;共价键;
;共价键; ;共价键.
;共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L NaCl溶液 | B. | 1 mol/LCaCl2溶液 | ||
| C. | 1 mol/L KCl溶液 | D. | 1 mol/LAlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com