
| n |
| V |
| 23.2g |
| 232g/mol |
| 0.1mol |
| 0.5L |
| 0.2mol |
| 0.5L |
| 0.2mol |
| 0.5L |
| 8.4g |
| 56g/mol |


科目:高中化学 来源: 题型:
| A、在水溶液中和熔融状态下均不导电的化合物叫非电解质 |
| B、电解质、非电解质都指化合物而言,单质不属于此范畴 |
| C、电解质在水中一定能导电,在水中导电的化合物一定是电解质 |
| D、酸、碱、盐、水是电解质,大部分有机物(酒精、蔗糖)、非金属氧化物是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
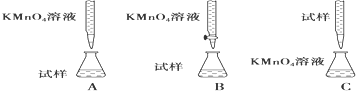
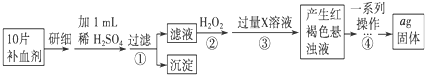
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①②③ |
| C、②③④⑤⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
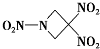
| A、分子中N、O间形成的共价键是非极性键 |
| B、分子中C原子的杂化轨道类型为sp3杂化 |
| C、第一电离能从大到小:O>N>C |
| D、该分子所有原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A->B->C->D- |
| B、D->C->B->A- |
| C、A->D->B->C- |
| D、D->B->A->C- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
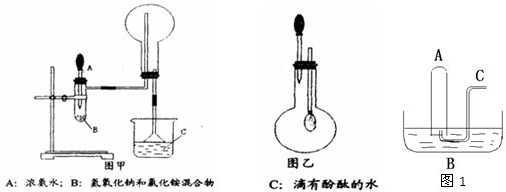
+ 4 |
+ 4 |
+ 4 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com