
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下离子中的若干种:NH4+、Ba2+、Fe2+、Cl-、NO3—、CO32—、SO42—。某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成如下实验:
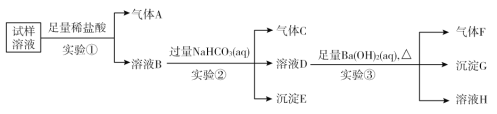
试回答下列问题:
(1)实验①中加入稀盐酸后,有气体A生成,溶液B依然澄清,且溶液中阴离子种类不变。据此可知原溶液中一定含有______________,一定不含______________。(填离子符号)
(2)实验①中发生反应的离子方程式为______________________________________。
(3)实验②中逐滴加入碳酸氢钠溶液,立即有气泡产生,反应的离子方程式为__________________,一段时间后又有沉淀出现,这时的离子方程式为____________。
(4)气体F的成分为________。(填化学式)
(5)根据实验③现象该同学认为原溶液中一定含有SO42—,有其他同学认为其结论不合理,又进行了后续实验④,最终确定原溶液中含有SO42—,试写出实验④可行的操作方法及现象_________________。
【答案】Cl-、Fe2+、NO3— CO32— 3Fe2++4H++NO3—=3Fe3++NO↑+2H2O H++HCO3—=CO2↑+H2O Fe3++3HCO3—=3CO2↑+Fe(OH)3↓ NH3 向沉淀G中加入足量稀盐酸,若沉淀未完全溶解,则含有SO42—[或取少量原溶液于试管中,滴加BaCl2溶液或Ba(NO3)2溶液,若产生白色沉淀,则含有SO42—]
【解析】
(1)实验①中加入稀盐酸后,有无色气体A生成,该气体可能为二氧化碳或NO,由于盐酸过量且溶液中阴离子种类不变,则生成的气体为NO,溶液中一定含有Fe2+、NO3-、Cl-,且NO3-过量;根据离子共存可知一定不存在CO32-;
(2)硝酸根离子在酸性条件下具有强氧化性,能够将亚铁离子氧化成铁离子,同时生成NO气体,据此写出反应的离子方程式;
(3)实验①中盐酸足量,则溶液B中含有过量的氢离子,加入碳酸氢钠后发生反应为:H++HCO3-===H2O+CO2↑;溶液B中还含有Fe3+,当氢离子反应完全后,铁离子与碳酸氢根离子发生相互促进的双水解反应,生成氢氧化铁沉淀和二氧化碳气体;
(4)溶液D中加入氢氧化钡溶液加热后生成气体F、沉淀G和溶液H,气体F为氨气,由于碳酸氢钠过量,则沉淀G中一定含有碳酸钡,可能含有硫酸钡;
(5)由于碳酸氢钠过量,则生成的沉淀中不一定含有硫酸钡,需要通过对沉淀G进一步检验,可向沉淀G中加入足量稀盐酸,若沉淀部分溶解,则说明原溶液中一定含有硫酸根离子。
(1)实验①中加入稀盐酸后,有无色气体A生成,该气体可能为CO2或NO,由于盐酸过量且反应后溶液中阴离子种类不变,则生成的气体为NO,溶液中一定含有Fe2+、Cl-、NO3-,且NO3-过量;根据离子共存可知一定不存在CO32-;
(2)实验①中亚铁离子与稀硝酸反应生成硝酸铁和一氧化氮和水,反应的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)实验①加入足量盐酸,则溶液B中含有过量的氢离子,加入碳酸氢钠后发生反应的离子方程式为:H++HCO3-=H2O+CO2↑;溶液B中还含有Fe3+,氢离子反应完全后,铁离子与碳酸氢根离子发生相互促进的双水解反应,生成氢氧化铁沉淀和二氧化碳气体,反应的离子方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;
(4)溶液D中加入足量Ba(OH)2溶液加热后生成气体F、沉淀G和溶液H,气体F为NH3,由于实验②中NaHCO3足量,则沉淀G中一定含有BaCO3,可能含有BaSO4;
(5)由于实验②中NaHCO3足量,则实验③的沉淀G中一定含有沉淀BaCO3,不能确定是否含有BaSO4,需要进行后续实验④,可向沉淀G中加入足量稀盐酸,若沉淀未完全溶解,则含有SO42-[或取少量原溶液于试管中,滴加BaCl2溶液或Ba(NO3)2溶液,若产生白色沉淀,则含有SO42-]。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂,可以用来制备氢氧化铁胶体。
(1)下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
a.向饱和氯化铁溶液中滴加少量的氢氧化钠稀溶液
b.加热煮沸氯化铁饱和溶液
c.![]() 氨水中滴加氯化铁浓溶液
氨水中滴加氯化铁浓溶液
d.在沸水中滴加饱和氯化铁溶液,煮沸至液体呈红褐色
(2)写出制备氢氧化铁胶体的离子方程式__________________________;
(3)下列与胶体性质无关的是_____________(填字母);
a.河流入海口处形成沙洲
b.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
c.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
d.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀
e.冶金厂常用高压电除去烟尘
(4)从溶液中分离提纯Fe(OH)3胶体的方法叫_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙丙三种物质间通过一步反应能实现如图转化,下列选项中符合转化关系的是( )
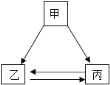
A.甲为NaOH,乙为NaCl,丙为NaNO3
B.甲为CuO,乙为CuCl2,丙为Cu(OH)2
C.甲为Na2CO3,乙为CO2,丙为CaCO3
D.甲为H2SO4,乙为BaSO4,丙为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水蒸气通过的灼热的焦炭后,流出气体的主要成分是 CO 和 H2,还有 CO2和水蒸气等。现利用下图中提供实验装置,证明上述混合气体中有CO 和 H2。(A中加热装置在图中略去)回答下列问题:
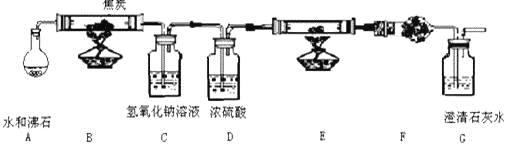
(1) C装置的用途是____________
(2)仪器 E 中需加入的试剂是_____________
(3)仪器 F 中需加入的试剂是:______,其目的是_________________
(4)装置F和G的位置能否颠倒_____,(填“能”或“否”)理由是____________________
(5)能证明混合气中含有 CO 的实验现象是________________________
(6)有人认为该实验装置存在一个缺陷,你认为这个缺陷是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J 是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
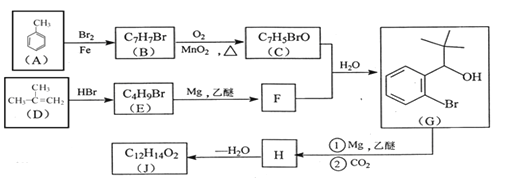
已知:RBr![]() RMgBr
RMgBr 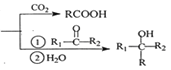
回答下列问题:
(1)B的结构简式是________________。C的结构简式是______________。
(2)D生成E的化学方程式为_________________。
(3)J的结构简式是________________。
(4)根据C ![]() X,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
X,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A 除苯环外无其他环,且无-O-O-键
B 能与FeCl3溶液发生显色反应
C 苯环上一氯代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用0.4 mol/LNaOH溶液480mL。配制方法如下:
(1)配制该溶液应选用________mL容量瓶;
(2)用托盘天平准确称量________g固体NaOH,应放在________(仪器)中称量。
(3)将称量好的NaOH固体放在500mL大烧杯中,倒入约100mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待______________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯________次,洗涤后的溶液_______________,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面接近刻度线__________时,改用_________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,上下颠倒混合均匀;
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是________,偏低的是________,对实验结果没有影响的是____________(填各选项的序号)。
A.所用的NaOH中混有少量Na2CO3
B.用带有生锈砝码的托盘天平称量一定质量固体NaOH
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Xe元素的所在族的原子的外围电子排布式均为ns2np6,属于非金属元素
B. 在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C. 某基态原子核外电子排布图为![]() 它违背了泡利原理
它违背了泡利原理
D. 某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com