
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
①单位时间内生成n mo1 O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
科目:高中化学 来源: 题型:
【题目】过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).
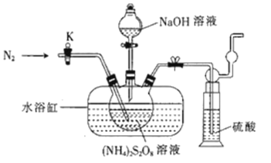
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1molL-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:

(1)指出提取碘的过程中有关的实验操作名称:①____________________;③______________。
若实验②中采用酸性条件下加入双氧水,则有关反应的离子方程式_________________________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
A.甲苯,酒精B.四氯化碳,苯C.汽油,乙酸D.汽油,甘油
(3)含碘的有机溶液后期处理得到晶态碘需要进行的操作为___________;
最后,晶态碘在___________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
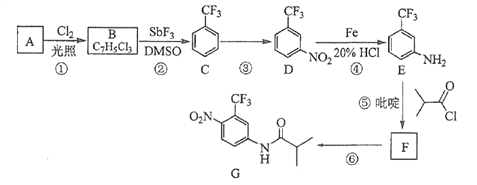
回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

(1)①装置A中发生反应的离子方程式是____________________。
②整套实验装置存在一处明显的不足,请指出__________________。
(2)用改正后的装置进行实验,实验过程如下:_______。
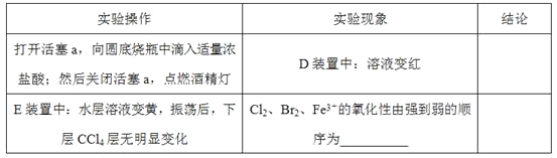
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因_______,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加___________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( )
2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( )
A. 用物质A表示反应的平均速率为0.3 mol·L-1·s-1
B. 用物质B表示反应的平均速率为0.3 mol·L-1·s-1
C. 2 s时物质A的转化率为70%
D. 2 s时物质B的浓度为0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列反应的叙述正确的是( )
A.由SiO2+2C![]() Si+2CO↑可推知硅的非金属性比碳强
Si+2CO↑可推知硅的非金属性比碳强
B.由CaCO3+SiO2![]() CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
C.由Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓可推知碳的非金属性比硅强
D.由Na2CO3+SiO2![]() Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
查看答案和解析>>
科目:高中化学 来源: 题型:
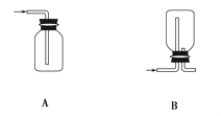
【题目】结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的装置中正确的是_______(填字母)。

漂白粉能与盐酸发生反应,但盐酸浓度不同时,漂白粉与盐酸混合发生反应的类型不同。
漂白粉与稀盐酸发生复分解反应,化学方程式为_________________________。漂白粉与浓盐酸发生氧化还原反应,化学方程式为____________________________________。
(2)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。

①能证明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。
②c过程中的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
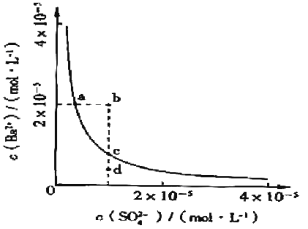
提示:BaSO4(s)=Ba2+(aq)+SO![]() (aq)的平衡常数Ksp=c(Ba2+)·c(SO
(aq)的平衡常数Ksp=c(Ba2+)·c(SO![]() ),称为溶度积常数。
),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com