
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A. W2-、X+ B. X+、Y3+
C. Y3+、Z2- D. X+、Z2-
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用之一是促进_______水解(填离子符号,下同),二是沉淀一部分_______。
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是_______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,_______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。
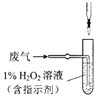
① H2O2氧化SO2的化学方程式_______。
② 废气中残留SO2的体积分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A. 0.1 mol/L的(NH4)2SO4溶液中:c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B. 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO![]() )+c(H2CO3)+2c(CO
)+c(H2CO3)+2c(CO![]() )
)
C. 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D. 在25℃0.1 mol/L的 NH4Cl溶液中:c(Cl-)=c(NH![]() )+c(NH3·H2O)
)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行氢氧化铁胶体的制备实验。
甲同学:向1 mol·L-1的氯化铁溶液中加少量氢氧化钠溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是____________,若丙同学实验中不停止加热,会看到___________。
(2)氢氧化铁胶体制备的化学方程式为_______________________________;
(3)证明有氢氧化铁胶体生成利用的胶体性质是_______,提纯所制氢氧化铁胶体常用的方法是________。
(4)利用氢氧化铁胶体进行实验:
①将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极区附近的颜色逐渐变深,这表明氢氧化铁胶体微粒带__________(填“正”或“负”)电荷;
②若向其中加入饱和硫酸钠溶液,产生的现象是________________________;
③若向其中逐滴加入稀盐酸,产生的现象是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含氧原子数目最多的是()
A. 4℃时12 mL的H2O B. 1.204×1023个NO2分子
C. 19.6 g H2SO4 D. 标况下11.2 L CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2 L的密闭容器中, 充入 1 mol N2 和 3 mol H2, 在一定的条件下反应, 2 分钟后达到平衡状态, 相同温度下, 测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10, 填写下列空白:
(1)平衡时混合气体中三种气体的物质的量比为 _________________
(2)N2 的转化率为 _______________
(3) 2分钟内, NH3 的平均反应速率为 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中能证明一种气体为SO2的是( )
①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红溶液褪色 ④通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生
A.都能证明
B.都不能证明
C.③④⑤能证明
D.只有⑤能证明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是
A. 用10mL量筒量取7.13mL稀盐酸
B. 用托盘天平称量25.20g NaCl
C. 用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
D. 用广泛pH试纸测得某溶液的pH为2.3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com