
丙二酸(H2A)的pKa1 = 2.86,pKa2 = 5.70,向20.00 mL Na2A、NaHA混合溶液中加入1.00 mL 0.0100 mol·L-1 HCl,pH为5.70;滴入同样浓度10.00 mL HCI,pH为4.28,求初始混合液中Na2A、NaHA浓度和pH。
科目:高中化学 来源: 题型:
某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:


请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:_________________________________________;
实验中若有m g铜参加了反应,则有______mol硫酸被还原,电子转移数目为___。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是__________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
__________________________________________________________________。
(3)为了测定消耗硫酸的物质的量,该兴趣小组设计了两个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
实际上,方案一、二均不可取。
方案一产生的气体中含有 ,使干燥管增重偏大;也可能由于
,使干燥管增重偏小。
方案二:由于 与氯化钡溶液反应,使测定消耗硫酸的物质的量结果偏大。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理为
H2 O2+I-—→H2O+IO- 慢
O2+I-—→H2O+IO- 慢
H2O2+IO-—→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1
D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
现欲用碳酸钙固体和稀盐酸反应制取CO2气体。请回答下列问题。
(1)写出发生反应的离子方程式:_________________________________________。
(2)实验过程中绘制出生成CO2的体积V(CO2)与时间t的关系如下图所示。试分析判断OE段、EF段、FG段反应速率[分别用v(OE)、v(EF)、v(FG)表示]的大小关系为____________;比较OE段和EF段,说明EF段速率变化的主要原因:
________________________________________________________________________。
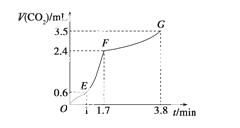
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.10 mol CH3COONa加到1.0 L 0.10 mol·L-1 CH3COOH溶液中(设加CH3COONa溶液体积不变),求溶液的pH(已知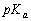 = 4.74)。
= 4.74)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
①电解池是将化学能转变成电能的装置 ②原电池是将电能转变成化学能的装置 ③金属和石墨导电均为物理变化,电解质溶液导电是化学变化 ④不能自发进行的氧化还原反应,通过电解的原理有可能实现 ⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.①②③④  B
B .③④
.③④
C.③④⑤ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 18g D2O含有的电子数为10NA
B. 标准状况下,11.2 L SO3中含有的分子数为0.5 NA
C. 7.8 g Na2O2晶体中含有的阴离子数为0.1 NA
D. 常温常压下,44 g CO2气体含有氧原子的个数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是( )
|
| A. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
|
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 |
|
| C. | 同主族元素的简单阴离子还原性越强,水解程度越大 |
|
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时,a:b不可能为( )
|
| A. | 3:4 | B. | 4:5 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com