
【题目】物质的结构决定性质。回答下列有关问题:
(1)BF3的空间构型为______。SO32-中心原子的杂化类型是______。
(2)H2S的沸点比H2O2的沸点______![]() 选填“高”或“低”
选填“高”或“低”![]() ;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
(3)从分子结构的角度分析“白磷不溶于水,易溶于CS2”的原因______。
(4)CuCl难溶于水但易溶于氨水,其原因是______;此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______。
(5)已知CaF2晶胞结构如图所示,晶体密度为![]() g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含
g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含![]() 、NA的代数式表达)
、NA的代数式表达)

(6)一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,该晶体中原子之间的作用力是______;该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为______。
【答案】平面正三角形 sp3 低 BN 白磷是非极性分子,水是极性分子,CS2是非极性分子,相似相溶 Cu+可与氨形成易溶于水的配位化合物(或配离子) [Cu(NH3)4]2+ ![]() 金属键 Cu3AuH8
金属键 Cu3AuH8
【解析】
(1)BF3中B原子形成3个B-F键,没有孤电子对,价层电子对数3+0=3,空间构型为平面正三角形;SO32-中心原子S原子孤电子对数=![]() =1,杂化轨道数目=3+1=4,S原子采取sp3杂化;
=1,杂化轨道数目=3+1=4,S原子采取sp3杂化;
(2)H2O2分子之间形成氢键,而H2S分子之间不能形成氢键,常温下前者为液体,后者为气体,故H2S的沸点比H2O2的沸点低;均属于原子晶体,原子半径B<Al<Ga,共价键键长:N-B<N-Al<N-Ga,故键能N-B>N-Al>N-Ga,因此BN的熔点最高;
(3)白磷是非极性分子,水是极性分子,CS2是非极性分子,相似相溶,因此白磷不溶于水,易溶于CS2;
(4)Cu+可与氨形成易溶于水的配位化合物(或配离子),所以该化合物易溶于氨水,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为[Cu(NH3)4]2+;
(5)晶胞中黑色球数目为8,白色球数目=8×![]() +6×
+6×![]() =4,故黑色球为F,白色球为Ca,晶胞质量=
=4,故黑色球为F,白色球为Ca,晶胞质量=![]() g,晶胞体积=
g,晶胞体积=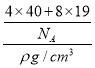 cm3,则晶胞的边长=
cm3,则晶胞的边长=![]() cm;
cm;
(6)该合金晶体中原子之间的作用力为金属键;该晶胞中Au原子个数=8×![]() =1、Cu原子个数=6×
=1、Cu原子个数=6×![]() =3,氢原子可进入到Cu原子与Au原子构成的四面体空隙中,H原子应位于晶胞内部,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,CaF2晶胞中含有4个Ca2+和8个F-,氢原子相当于晶胞中的F离子,则晶胞中Cu、Au原子总数与H原子数目之比为1:2,所以该晶胞中应含有8个H,该晶体储氢后的化学式为Cu3AuH8。
=3,氢原子可进入到Cu原子与Au原子构成的四面体空隙中,H原子应位于晶胞内部,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,CaF2晶胞中含有4个Ca2+和8个F-,氢原子相当于晶胞中的F离子,则晶胞中Cu、Au原子总数与H原子数目之比为1:2,所以该晶胞中应含有8个H,该晶体储氢后的化学式为Cu3AuH8。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】混合溶液中离子浓度大小比较(一般情况弱电解质的电离程度约为百分之一,而盐类水解程度约为千分之一)
(1)等物质的量的NH3·H2O和NH4Cl的混合溶液中存在的水解平衡是____,存在的电离平衡是____(不写水的电离平衡),由于NH3·H2O的电离程度_____NH4Cl的水解程度,故溶液显____性。溶液中离子浓度大小关系是_________。
(2)等物质的量的CH3COOH和CH3COONa的混合溶液中存在的水解平衡是____,存在的电离平衡是_______(不写水的电离平衡),由于CH3COOH的电离程度_____CH3COONa的水解程度,故溶液显____性。溶液中离子浓度大小关系是_________。
(3)等物质的量的HCN和NaCN的混合溶液中存在的水解平衡是___,存在的电离平衡是___(不写水的电离平衡),由于HCN的电离程度_____NaCN的水解程度,故溶液显____性。溶液中离子浓度大小关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产苯乙烯是利用乙苯的脱氢反应如下,针对上述反应,在其它条件不变时,下列说法正确的是( )

A. 加入适当催化剂,可以提高苯乙烯的产量
B. 在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
C. 仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
D. 加入乙苯至反应达到平衡过程中,混合气体的平均相对分子质量不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】左乙拉西坦(物质G)是一种治疗癫痫的药物,可通过以下方法合成:

(1)B中的含氧官能团名称为_______。
(2)E→F的反应类型为_________。
(3)X的分子式为C4H7ON,写出X的结构简式:____________。
(4)写出同时满足下列条件的G的一种同分异构体的结构简式:________。
① 能发生水解反应,水解产物仅有一种,且为α-氨基酸;
② 分子中含六元环结构,且有4种不同化学环境的氢。
(5)请以![]() 和
和![]() 为原料制备
为原料制备 ,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。
,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2009年《化学教育》期刊封面刊载如图所示的有机物M(只含C、H、O)的球棍模型图。不同大小、颜色的小球代表不同的原子,小球之间的“棍”表示共价键,既可以表示三键,也可以表示双键,还可以表示单键。下列有关M的推断正确的是( )
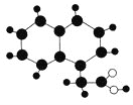
A. M的分子式为C12H12O2
B. M与足量氢气在一定条件下反应的产物的环上一氯代物有7种
C. M能发生中和反应、取代反应
D. 一个M分子最多有11个原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氢弥猴桃内酯(J)是一种调配烟草用香精,制备该物质的合成路线如下:

已知:A、B、C中含有一种相同的官能团,B和C中均含有两个甲基。
(1)A的化学名称是_________;Ⅰ中所含官能团的名称是_________。
(2)A生成B或C的反应类型是_________,G生成H的反应类型是_________。
(3)A在催化剂作用下发生加聚反应,生成的常见高分子化合物的结构简式为_________。
D生成E所用的试剂为乌洛托品,其相对分子质量为140,可由甲醛与氨气以物质的量之比3∶2反应脱去水得到,乌洛托品分子中有4个六元环,所有氢原子化学环境相同,乌洛托品的分子式为_________,结构简式为_____________________________。
(4)化合物E与足量H2 在催化剂及加热条件下反应的化学方程式为________________________。
(5)芳香族化合物X是J 的同分异构体,1mol X能与2mol NaOH 反应,X的核磁共振氢谱有5组峰,且峰面积之比为1∶1∶2∶6∶6,写出一种符合条件的X的结构简式:__________________。
(6)写出以1-丙醇为原料(其他试剂任选)制备2-丁烯酸的合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
元素 | 相关信息 |
A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B | 元素原子的核外p电子数比s电子数少1 |
C | 原子的第一至第四电离能分别是I1=738 kJ·mol-1; I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
D | 原子核外所有p轨道全满或半满 |
E | 元素的主族序数与周期数的差为4 |
F | 是前四周期中电负性最小的元素 |
G | 在周期表的第七列 |
(1)B基态原子中能量最高的电子,其电子云在空间有______个伸展方向,原子轨道呈________形。
(2)某同学根据上述信息,推断C基态原子的轨道表示式为![]() 该同学所画的轨道表示式违背了________________。
该同学所画的轨道表示式违背了________________。
(3)G位于______族__________区,价电子排布式为________________。
(4)检验F元素的方法是________,请用原子结构的知识解释产生此现象的原因:_____________。
(5)写出E的单质与水反应的离子方程式:_____________________________________
(6)写出DA3的电子式_______________________(用元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com