
| 化学键 | H-Cl | Cl-Cl | H-H | C-H | C-Cl |
| 键能/(kJ•mol-1) | 431.4 | 242.1 | 435.9 | 413.0 | 338.9 |
分析 化学反应中旧键断裂需要吸收能量,新键形成需要放出能量,化学反应中的反应热△H=反应物总键能-生成物总键能,据此结合Cl2+H2=2HCl,Cl2(g)+CH4(g)═CH3Cl(g)+HCl(g)以及表中键能值解答,△H>0吸热,反之放热.
解答 解:(1)Cl2+H2=2HCl,△H=反应物的键能和-生成物的键能和=242.1 KJ/mmol+435.9KJ/mol-2×431.4KJ/mol=-184.8KJ/mol,△H<0反应放热,生成1molHCl时放热184.8×$\frac{1}{2}$KJ=92.4KJ,
答:由Cl2(g)和H2(g)化合生成1molHCl(g)时所释放的能量为92.4KJ;
(2)1molCH4中含有4molC-H键,反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H=-106kJ/mol,反应焓变△H=4×[C-H]+[Cl-Cl]-[(C-Cl)+3×(C-H)+(H-Cl)]=4×[413.0]+[242.1]-[(338.9 )+3×(413.0 )+(431.4)]KJ/mol=-115.2KJ/mol,△H<0该反应放热,
答:甲烷的氯代反应Cl2(g)+CH4(g)═CH3Cl(g)+HCl(g),是放热反应.
点评 本题考查反应热与化学键的关系,要正确利用利用△H=反应物的键能和-生成物的键能和,注意△H与化学计量数的对应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释 |
| A | 向AlCl3溶液中逐滴加入NaOH溶液并振荡 | 产生白色沉淀,后沉淀逐渐溶解 | 铝元素具有一定的非金属性 |
| B | 将Fe(NO3)2固体溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | 稀硫酸将Fe2+氧化为Fe3+ |
| C | 向KBrO3溶液中加入少量CCl4,然后通入少量Cl2,充分振荡,静置 | 下层呈橙色 | 氧化性:Cl2>Br2 |
| D | 将充有NO2的玻璃球放入热水中 | 红棕色加深 | 2NO2?N2O4△H>0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 | |
| 起始量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 0~5min内,甲中SO2的反应速率为0.032mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=400 | |
| C. | 平衡时,SO2的转化率:α1<80%<α2 | |
| D. | 平衡时,丙中气体平均相对分子质量与甲相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中3个碳原子在同一直线上 | |
| B. | 分子中所有原子都在同一平面上 | |
| C. | 分子中共价键的夹角为120° | |
| D. | 分子中共价键数为8,其中有一个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用蓝绿藻等低等生物和微生物在阳光作用下使水分解产生氢气,该方法符合绿色化学原则 | |
| B. | 12C、13C和14C互为同位素,它们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| C. | 食品脱氧剂(含铁粉、氯化钠、炭粉等)的脱氧原理与钢铁的吸氧腐蚀相同 | |
| D. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:填空题
生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO 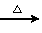 CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L0.lmol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。求:
CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L0.lmol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。求:
(1)原混合气体中甲烷的体积(标准状况)(写出计算过程)
(2)反应后的气体中CO2的物质的量可能为___________
(3)原混合气体中氮气的体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com