
| A. | 由分子构成的物质中一定含有共价键 | |
| B. | 形成共价键的元素不一定是非金属元素 | |
| C. | 正四面体结构的分子中的键角一定是109°28′ | |
| D. | ClO2-的空间构型为直线型 |
分析 A、单原子分子中不含有共价键;
B、形成共价键的元素一般是非金属元素,但有例外,如氯化铝;
C、白磷是正四面体结构,键角为60°;
D、根据ClO2-中Cl原子的价层电子对数判断.
解答 解:A、由分子组成的物质中不一定含有共价键,如稀有气体,故A错误;
B、氯化铝是共价化合物,氯原子和铝原子形成共价键,故B正确;
C、正四面体结构的分子中键角不一定是109028,如白磷是正四面体结构,键角为60°,故C错误;
D、ClO2-中Cl原子的价层电子对数=2+$\frac{1}{2}$(7+1-2×2)=4,含有2个孤电子对,空间构型为V形,故D错误.
故选B.
点评 本题考查了分子构型的判断与理解、共价键的概念及应用、微粒的空间构型的判断等内容,难度不大,注意相关基础知识的积累,侧重于考查学生的分析能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 从上至下,卤素单质的密度依次增大,碱金属单质的密度也依次增大 | |
| B. | 从上至下,卤素单质的沸点逐渐升高,碱金属单质的熔点逐渐降低 | |
| C. | 除了I2外,其它卤素单质都能将Fe氧化到+3价 | |
| D. | F2不能从NaCl溶液中置换出Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| B. | 家用天然气含有特殊气味的主要原因是开采的天然气未经处理就直接转为民用燃气 | |
| C. | 节日焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 稳定性:HF<HCl<HBr<HI | ||
| C. | 与H2反应由易到难:F2>Cl2>Br2>I2 | D. | 还原性:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 | |
| B. | 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动 | |
| C. | 乙酸与丙二酸互为同系物 | |
| D. | 同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Y- | |
| C. | 同族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
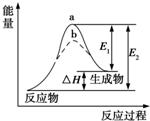
| A. | 该反应为吸热反应,△H=E1-E2 | |
| B. | 使用催化剂,△H减小 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 如图可知b使用了催化剂,反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com