
| A. | 25% | B. | 40% | C. | 50% | D. | 60% |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
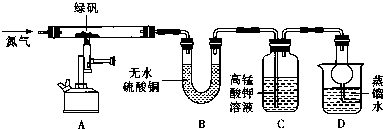
| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将过量SO2气体通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| C. | 用醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片与浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向漂白精溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | H2C2O4溶液能使KMnO4酸性溶液褪色 2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
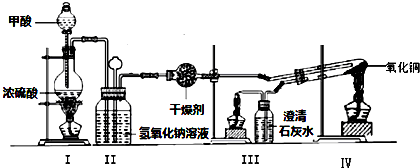
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )| A. | 能发生取代反应、加成反应、消去反应 | |
| B. | 1mol该物质中含有苯环的物质的量为1mol | |
| C. | 该物质在酸性条件下加热水解可以得到乙醇 | |
| D. | 与足量NaOH溶液反应,最多消耗4nmolNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com