
ЎҫМвДҝЎҝAgNO3КЗЦРС§»ҜС§іЈУГКФјБЈ¬ДіРЛИӨРЎЧйЙијЖИзПВКөСйМҪҫҝЖдРФЦКЎЈ
I. AgNO3өДИИОИ¶ЁРФ
AgNO3КЬИИТЧ·ЦҪвЈ¬УГПВНјЧ°ЦГјУИИAgNO3№ММеЈ¬КФ№ЬДЪУРәмЧШЙ«ЖшМеЙъіЙЈ¬Т»¶ОКұјдәуЈ¬ФЪД©¶Лөј№ЬҝЪҝЙКХјҜөҪОЮЙ«ЖшМеaЎЈ

(1)КөСйКТјмСйЖшМеaөД·Ҫ·ЁОӘ_______________________________________ЎЈ
(2)ТСЦӘBЦРЦ»ЙъіЙТ»Т»ЦЦСОЈ¬ҫЭҙЛЕР¶ПAgNO3КЬИИ·ЦҪвөД»ҜС§·ҪіМКҪОӘ______________ЎЈ
(3)ҙУ°ІИ«ҪЗ¶ИҝјВЗЈ¬ЙПКцКөСйЧ°ЦГҙжФЪТ»ҙҰГчПФИұПЭЈ¬ёДҪшҙлК©ОӘ______________________ЎЈII. AgNO3УлСОИЬТәөД·ҙУҰ

(4)јЧН¬С§ИПОӘКФ№ЬўЪЦРІъЙъТшҫөКЗFe2+ЛщЦВЈ¬ЖдАлЧУ·ҪіМКҪОӘ_____________________Ј»
ТТН¬С§ИПОӘТӘЕР¶ПёГ№ЫөгХэИ·Ј¬РиФцјУИзПВКөСйЈ¬ИЎ2 mL0.5mol/L AgNO3ИЬТәУЪКФУӘЦРЈ¬ПтЖдЦРВъјУјёөО____________Ј¬ИфЦ»ІъЙъ°ЧЙ«Ф¶өнЈ¬ЦӨГчјЧН¬С§№ЫөгХэИ·ЎЈ
(5)ТСЦӘЈәAgSCNОӘ°ЧЙ«іБөнЎЈКФ№ЬўЫЦРәмЙ«НКИҘөДФӯТтОӘ__________________________(ЗлҙУЖҪәвТЖ¶ҜөДҪЗ¶ИҪвКН)ЎЈ
(6)ЙијЖКөСйЦӨГчKsp(AgI)sp(AgSCN)ЎЈ
ПЮСЎКФјБЈә0.1 mol/L AgNO3ИЬТәЎў0.1mol/LKIИЬТәЎў0.1mol/LKSCN ИЬТә___________________________________________________________ЎЈ
Ўҫҙр°ёЎҝ Ҫ«ҙш»рРЗөДДҫМх·ЕЦБөј№ЬҝЪЈ¬ДҫМхёҙИј 2AgNO3![]() 2AgЈ«2NO2ЎьЈ«O2Ўь AЎўBЧ°ЦГЦ®јдБ¬ҪУТ»ёц·Аө№ОьөД°ІИ«Жҝ AgЈ«Ј«Fe2Ј«ЈҪAgЈ«Fe3Ј« 0.5 mol/L (NH4)2SO4ИЬТә ИЬТәЦР·ўЙъFe3Ј«Ј«3SCNЈӯ
2AgЈ«2NO2ЎьЈ«O2Ўь AЎўBЧ°ЦГЦ®јдБ¬ҪУТ»ёц·Аө№ОьөД°ІИ«Жҝ AgЈ«Ј«Fe2Ј«ЈҪAgЈ«Fe3Ј« 0.5 mol/L (NH4)2SO4ИЬТә ИЬТәЦР·ўЙъFe3Ј«Ј«3SCNЈӯ![]() Fe(SCN)3К№ҫЦІҝұдәмЈ»ХсөҙКФ№ЬКұЈ¬№эБҝөДAgЈ«УлSCNЈӯ·ҙУҰЙъіЙAgSCNіБөнЈ¬ҪөөНБЛc(SCNЈӯ)Ј¬ЖҪәвДжПтТЖ¶ҜЈ¬ИЬТәНКЙ« ·Ҫ°ёТ»ЈәПтКўУР0.1 mol/L AgNO3ИЬТәөДКФ№ЬЦРөОјУ0.1 mol/L KSCNИЬТәЦБІ»ФЩУР°ЧЙ«іБөнЙъіЙЈ¬ПтЖдЦРөОјУ0.1 mol/L KIИЬТәЈ¬°ЧЙ«іБөнЧӘ»ҜОӘ»ЖЙ«іБөнЈ¬ФтЦӨГчKsp(AgI)©ӮKsp(AgSCN)ЎЈ·Ҫ°ё¶юЈәҪ«өИМе»эөД0.1 mol/L KSCNИЬТәәН0.1 mol/L KIИЬТә»мәПЈ¬Пт»мәПТәЦРөОјУ0.1 mol/L AgNO3ИЬТәЈ¬ИфЙъіЙ»ЖЙ«іБөнЈ¬ФтЦӨГчKsp(AgI)©ӮKsp(AgSCN)ЎЈ
Fe(SCN)3К№ҫЦІҝұдәмЈ»ХсөҙКФ№ЬКұЈ¬№эБҝөДAgЈ«УлSCNЈӯ·ҙУҰЙъіЙAgSCNіБөнЈ¬ҪөөНБЛc(SCNЈӯ)Ј¬ЖҪәвДжПтТЖ¶ҜЈ¬ИЬТәНКЙ« ·Ҫ°ёТ»ЈәПтКўУР0.1 mol/L AgNO3ИЬТәөДКФ№ЬЦРөОјУ0.1 mol/L KSCNИЬТәЦБІ»ФЩУР°ЧЙ«іБөнЙъіЙЈ¬ПтЖдЦРөОјУ0.1 mol/L KIИЬТәЈ¬°ЧЙ«іБөнЧӘ»ҜОӘ»ЖЙ«іБөнЈ¬ФтЦӨГчKsp(AgI)©ӮKsp(AgSCN)ЎЈ·Ҫ°ё¶юЈәҪ«өИМе»эөД0.1 mol/L KSCNИЬТәәН0.1 mol/L KIИЬТә»мәПЈ¬Пт»мәПТәЦРөОјУ0.1 mol/L AgNO3ИЬТәЈ¬ИфЙъіЙ»ЖЙ«іБөнЈ¬ФтЦӨГчKsp(AgI)©ӮKsp(AgSCN)ЎЈ
ЎҫҪвОцЎҝҝјІйКөСй·Ҫ°ёЙијЖУлЖАјЫЈ¬I.ЈЁ1Ј©ёщҫЭКөСйЈ¬јУИИПхЛбТшЈ¬УРәмЧШЙ«ЖшМеІъЙъЈ¬ЛөГчІъЙъNO2Ј¬НЁ№эЧ°ЦГBәуЈ¬ФЪД©¶Лөј№ЬҝЪҝЙКХјҜөҪОЮЙ«ЖшМеЈ¬ОЮЙ«ЖшМеҝЙДЬОӘСхЖшЈ¬јмСйСхЖшөД·Ҫ·ЁКЗҪ«ҙш»рРЗөДДҫМх·ЕЦБөј№ЬҝЪЈ¬ДҫМхёҙИјЈ»ЈЁ2Ј©NO2УлNaOH·ҙУҰЈә2NO2Ј«2NaOH=NaNO2Ј«NaNO3Ј«H2OЈ¬СхЖшДЬ°СNaNO2Сх»ҜіЙNaNO3Ј¬ёщҫЭРЕПўЈ¬BЦРЦ»ЙъіЙТ»ЦЦСОЈ¬ЛөГчСхЖш№эБҝЈ¬ёщҫЭөГК§өзЧУКэДҝКШәгЈ¬AgөД»ҜәПјЫҪөөНЈ¬НЖ¶ПіцПхЛбТшКЬИИ·ЦҪвөД·ҪіМКҪОӘЈә2AgNO3![]() 2AgЈ«2NO2ЎьЈ«O2ЎьЈ»ЈЁ3Ј©NO2ДЬУлNaOH·ўЙъ·ҙУҰЈ¬ИЭТЧФміЙөј№ЬДЪөДЖшМеС№ЗҝјхРЎЈ¬ИЭТЧТэЖрө№ОьЈ¬ТтҙЛ AЎўBЧ°ЦГЦ®јдБ¬ҪУТ»ёц·Аө№ОьөД°ІИ«ЖҝЈ»ЈЁ4Ј©AgЈ«өДСх»ҜРФұИFe3Ј«ЗҝЈ¬ТтҙЛ·ўЙъAgЈ«Ј«Fe2Ј«=Fe3Ј«Ј«AgЈ»ёщҫЭўЪөДКөСйПЦПуТФј°ИфЦ»ІъЙъ°ЧЙ«іБөнЈ¬ЦӨГчјЧН¬С§№ЫөгХэИ·Ј¬НЖіцЛщјУИЬТәОӘ0.5molЎӨLЈӯ1(NH4)2SO4Ј»ЈЁ5Ј©ИЬТәЦР·ўЙъFe3Ј«Ј«3SCNЈӯ
2AgЈ«2NO2ЎьЈ«O2ЎьЈ»ЈЁ3Ј©NO2ДЬУлNaOH·ўЙъ·ҙУҰЈ¬ИЭТЧФміЙөј№ЬДЪөДЖшМеС№ЗҝјхРЎЈ¬ИЭТЧТэЖрө№ОьЈ¬ТтҙЛ AЎўBЧ°ЦГЦ®јдБ¬ҪУТ»ёц·Аө№ОьөД°ІИ«ЖҝЈ»ЈЁ4Ј©AgЈ«өДСх»ҜРФұИFe3Ј«ЗҝЈ¬ТтҙЛ·ўЙъAgЈ«Ј«Fe2Ј«=Fe3Ј«Ј«AgЈ»ёщҫЭўЪөДКөСйПЦПуТФј°ИфЦ»ІъЙъ°ЧЙ«іБөнЈ¬ЦӨГчјЧН¬С§№ЫөгХэИ·Ј¬НЖіцЛщјУИЬТәОӘ0.5molЎӨLЈӯ1(NH4)2SO4Ј»ЈЁ5Ј©ИЬТәЦР·ўЙъFe3Ј«Ј«3SCNЈӯ![]() Fe(SCN)3К№ҫЦІҝұдәмЈ»ХсөҙКФ№ЬКұЈ¬№эБҝөДAgЈ«УлSCNЈӯ·ҙУҰЙъіЙAgSCNіБөнЈ¬ҪөөНБЛc(SCNЈӯ)Ј¬ЖҪәвДжПтТЖ¶ҜЈ¬ИЬТәНКЙ«Ј»ЈЁ6Ј©·Ҫ°ёТ»ЈәПтКўУР0.1 molЎӨLЈӯ1 AgNO3ИЬТәөДКФ№ЬЦРөОјУ0.1 molЎӨLЈӯ1 KSCNИЬТәЦБІ»ФЩУР°ЧЙ«іБөнЙъіЙЈ¬ПтЖдЦРөОјУ0.1 molЎӨLЈӯ1 KIИЬТәЈ¬°ЧЙ«іБөнЧӘ»ҜОӘ»ЖЙ«іБөнЈ¬ФтЦӨГчKsp(AgI)©ӮKsp(AgSCN)ЎЈ·Ҫ°ё¶юЈәҪ«өИМе»эөД0.1 molЎӨLЈӯ1 KSCNИЬТәәН0.1 molЎӨLЈӯ1 KIИЬТә»мәПЈ¬Пт»мәПТәЦРөОјУ0.1 molЎӨLЈӯ1 AgNO3ИЬТәЈ¬ИфЙъіЙ»ЖЙ«іБөнЈ¬ФтЦӨГчKsp(AgI)©ӮKsp(AgSCN)ЎЈ
Fe(SCN)3К№ҫЦІҝұдәмЈ»ХсөҙКФ№ЬКұЈ¬№эБҝөДAgЈ«УлSCNЈӯ·ҙУҰЙъіЙAgSCNіБөнЈ¬ҪөөНБЛc(SCNЈӯ)Ј¬ЖҪәвДжПтТЖ¶ҜЈ¬ИЬТәНКЙ«Ј»ЈЁ6Ј©·Ҫ°ёТ»ЈәПтКўУР0.1 molЎӨLЈӯ1 AgNO3ИЬТәөДКФ№ЬЦРөОјУ0.1 molЎӨLЈӯ1 KSCNИЬТәЦБІ»ФЩУР°ЧЙ«іБөнЙъіЙЈ¬ПтЖдЦРөОјУ0.1 molЎӨLЈӯ1 KIИЬТәЈ¬°ЧЙ«іБөнЧӘ»ҜОӘ»ЖЙ«іБөнЈ¬ФтЦӨГчKsp(AgI)©ӮKsp(AgSCN)ЎЈ·Ҫ°ё¶юЈәҪ«өИМе»эөД0.1 molЎӨLЈӯ1 KSCNИЬТәәН0.1 molЎӨLЈӯ1 KIИЬТә»мәПЈ¬Пт»мәПТәЦРөОјУ0.1 molЎӨLЈӯ1 AgNO3ИЬТәЈ¬ИфЙъіЙ»ЖЙ«іБөнЈ¬ФтЦӨГчKsp(AgI)©ӮKsp(AgSCN)ЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ»ҜәПОпAЈЁC4H10OЈ©КЗТ»ЦЦУР»ъИЬјБЈ®AҝЙТФ·ўЙъТФПВұд»ҜЈә 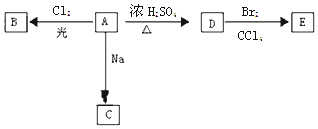
ЈЁ1Ј©A·ЦЧУЦРөД№ЩДЬНЕГыіЖКЗ Ј®
ЈЁ2Ј©ИфAЦ»УРТ»ЦЦТ»ВИИЎҙъОпBЈ®РҙіцУЙDЧӘ»ҜОӘEөД»ҜС§·ҪіМКҪЈә Ј®
ЈЁ3Ј©ИфAөДН¬·ЦТм№№МеFТІҝЙТФУРҝтНјДЪAөДёчЦЦұд»ҜЈ¬ЗТFөДТ»ВИИЎҙъОпУРИэЦЦЈ® ФтFөДҪб№№јтКҪКЗ Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝВИЛбјШЈЁKClO3Ј©ЦРЈ¬ВИФӘЛШөД»ҜәПјЫКЗ ЈЁ Ј©
A.-1B.+1C.+3D.+5
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҪ«·ҙУҰ Cu(s)+2Ag+(aq) == Cu2+(aq)+2Ag(s)ЙијЖіЙИзНјЛщКҫФӯөзіШЎЈПВБРЛө·ЁЦРХэИ·өДКЗ( )

A. өзј«XКЗХэј«,Ждөзј«·ҙУҰОӘCu-2e-== Cu2+
B. Тшөзј«°еЦКБҝЦрҪҘјхРЎЈ¬YИЬТәЦРc(Ag+)Фцҙу
C. өұXөзј«ЦКБҝұд»Ҝ0.64 gКұЈ¬YИЬТәЦКБҝұд»Ҝ2.16 g
D. НвөзВ·ЦРөзБчУЙТшј«БчПтНӯј«
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝі¬ТфЛЩ·Й»ъФЪЖҪБчІг·ЙРРКұЈ¬ОІЖшЦРөДNO»бЖЖ»өіфСхІгЈ®ҝЖС§јТХэФЪСРҫҝАыУГҙЯ»ҜјјКхҪ«ОІЖшЦРөДNOәНCOЧӘұдіЙCO2әНN2 Ј¬ »ҜС§·ҪіМКҪИзПВЈә2NOЈЁgЈ©+2COЈЁgЈ© ![]() 2CO2ЈЁgЈ©+N2ЈЁgЈ©ЎчHЈј0
2CO2ЈЁgЈ©+N2ЈЁgЈ©ЎчHЈј0
ОӘБЛІв¶ЁФЪДіЦЦҙЯ»ҜјБЧчУГПВөД·ҙУҰЛЩВКЈ¬ФЪДіОВ¶ИПВУГЖшМеҙ«ёРЖчІвөГІ»Н¬КұјдөДNOәНCOЕЁ¶ИИзұнЈә
КұјдЈЁsЈ© | 0 | 1 | 2 | 3 | 4 | 5 |
cЈЁNOЈ© | 1.00ЎБ10©Ғ3 | 4.50ЎБ10©Ғ4 | 2.50ЎБ10©Ғ4 | 1.50ЎБ10©Ғ4 | 1.00ЎБ10©Ғ4 | 1.00ЎБ10©Ғ4 |
cЈЁCOЈ© | 3.60ЎБ10©Ғ3 | 3.05ЎБ10©Ғ3 | 2.85ЎБ10©Ғ3 | 2.75ЎБ10©Ғ3 | 2.70ЎБ10©Ғ3 | 2.70ЎБ10©Ғ3 |
Зл»ШҙрПВБРОКМвЈЁҫщІ»ҝјВЗОВ¶Иұд»Ҝ¶ФҙЯ»ҜјБҙЯ»ҜР§ВКөДУ°ПмЈ©Јә
ЈЁ1Ј©З°2sДЪөДЖҪҫщ·ҙУҰЛЩВКҰФЈЁN2Ј©= Ј¬ COөДЖҪәвЧӘ»ҜВКОӘ Ј® ЈЁҪб№ыҫщұЈБфБҪО»УРР§КэЧЦЈ©
ЈЁ2Ј©РҙіцёГ·ҙУҰөДЖҪәвіЈКэKөДұнҙпКҪ Ј®
ЈЁ3Ј©јЩЙиФЪГЬұХИЭЖчЦР·ўЙъЙПКц·ҙУҰЈ¬ҙпөҪЖҪәвКұПВБРҙлК©ДЬМбёЯNOЧӘ»ҜВКөДКЗ Ј®
A.СЎУГёьУРР§өДҙЯ»ҜјБ
B.ЙэёЯ·ҙУҰМеПөөДОВ¶И
C.ҪөөН·ҙУҰМеПөөДОВ¶И
D.ЛхРЎИЭЖчөДМе»э
ЈЁ4Ј©СРҫҝұнГчЈәФЪК№УГөИЦКБҝҙЯ»ҜјБКұЈ¬ФцҙуҙЯ»ҜјБұИұнГж»эҝЙМбёЯ»ҜС§·ҙУҰЛЩВКЈ®ДіН¬С§ЙијЖБЛИэЧйКөСйЈ¬КөСйМхјюТСҫӯМоФЪПВГжКөСйЙијЖұнЦРЈ®
КөСй | TЈЁЎжЈ© | NOіхКјЕЁ¶И | COіхКјЕЁ¶И | ҙЯ»ҜјБөДұИұнГж»эЈЁm2/gЈ© |
ўс | 280 | 1.20ЎБ10©Ғ3 | 5.80ЎБ10©Ғ3 | 82 |
ўт | 280 | 1.20ЎБ10©Ғ3 | 5.80ЎБ10©Ғ3 | 124 |
ўу | 350 | 1.20ЎБ10©Ғ3 | 5.80ЎБ10©Ғ3 | 124 |
ўЩТФЙПИэЧйКөСйөДКөСйДҝөДКЗ Ј®
ўЪЗлФЪёшіцөДЧшұкНјЦРЈ¬»ӯіцЙПұнЦРөДөЪИэёцКөСйМхјюПВ»мәПЖшМеЦРNOЕЁ¶ИЛжКұјдұд»ҜөДЗчКЖЗъПЯНј Ј® 
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВНјКЗІЙУГРВДЬФҙҙўДЬЖчјюҪ«CO2ЧӘ»ҜОӘ№ММеІъОпЈ¬КөПЦCO2өД№М¶ЁәНҙўДЬБй»оУҰУГөДЧ°ЦГЎЈҙўДЬЖчјюК№УГөДLi-CO2өзіШЧйіЙОӘоЙөзј«/CO2-ұҘәНLiClO4-DMSOөзҪвТә/п®Ж¬ЎЈПВБРЛө·ЁХэИ·өДКЗ

A. Li-CO2өзіШөзҪвТәУЙLiClO4әНDMSOИЬУЪЛ®өГөҪ
B. CO2өД№М¶ЁЦРЈ¬ГҝЧӘТЖ8mole-Ј¬ЙъіЙ3molЖшМе
C. №эіМўтЦРөзДЬЧӘ»ҜОӘ»ҜС§ДЬ
D. №эіМўсөДоЙөзј«өДөзј«·ҙУҰКҪОӘ2Li2CO3+C-4e-=4Li++3CO2Ўь
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘДіҝЙДж·ҙУҰФЪГЬұХИЭЖчЦРҪшРРЈәAЈЁgЈ©+2BЈЁgЈ©3CЈЁgЈ©+DЈЁsЈ©ЎчHЈј0Ј¬НјЦРЗъПЯa ҙъұнТ»¶ЁМхјюПВёГ·ҙУҰөД№эіМЈ¬ИфК№aЗъПЯұдОӘbЗъПЯЈ¬ҝЙІЙУГөДҙлК©КЗЈЁЎЎЎЎЈ©
A.ФцҙуAөДЕЁ¶И»тјхЙЩCөДЕЁ¶И
B.ЛхРЎИЭЖчөДИЭ»э»тјУИлҙЯ»ҜјБ
C.ЙэёЯОВ¶И»тФцҙуС№Зҝ
D.ЙэёЯОВ¶И
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДЙГЧМјЛбёЖКЗТ»ЦЦ№г·әУҰУГУЪЛЬБПЎўКіЖ·ЎўТҪТ©ЎўЛЗБПөИРРТөөДЦШТӘОЮ»ъМоБПЎЈТФБЧКҜёаёЖФьОӘФӯБПЦЖИЎёЯЖ·ЦКДЙГЧМјЛбёЖөД№ӨТХБчіМИзПВЈә

ТСЦӘДіБЧКҜёаёЖФьөДЦчТӘіЙ·Цј°Ждә¬БҝИзПВұнЛщКҫЎЈ
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | ЙХК§Бҝ |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
Зл»ШҙрПВБРОКМвЈә
ЈЁ1Ј©¶ФБЧКҜёаёЖФьҪшРРЛбИЬөДДҝөДКЗ»сөГ»ъЦЖCaCl2ИЬТәЈ¬ОӘБЛМбёЯИЬіцВКЈ¬ҝЙТФІЙИЎөДҙлК©УР______ЎЈЈЁ»ШҙрБҪМхјҙҝЙЈ©
ЈЁ2Ј©ОӘБЛМҪҫҝЛбИЬөД№ӨТХМхјю,іЖИЎ6 ·Эёч50gБЧКҜёаёЖФьЈ¬·ЦұрУГІ»Н¬ЕЁ¶ИСОЛбҪшРРИЬҪвЈ¬·ҙУҰКұјдОӘ30 min,ІвөГВЛТәЦРёЖИЬіцВКөДҪб№ыИзНјЛщКҫЈ¬ЧоККТЛөДСОЛбЕЁ¶ИОӘ_______ЎЈ

ЈЁ3Ј©ҫ«ЦЖКЗПтҙЦЦЖCaCl2ИЬТәЦРНЁИл°ұЖш,ҝШЦЖИЬТәөДpH,ЦчТӘіэИҘ________ (МоҪрКфСфАлЧУ)ЎЈ
ЈЁ4Ј©Мј»ҜКұЈ¬ПИҪ«ҫ«ЦЖCaCl2ИЬТәПЎКНЦБТ»¶ЁМе»эЈ¬ҝШЦЖ·ҙУҰОВ¶ИТФј°NH3әНCO2 өДНЁИлБҝ,ҙЛ№эіМЦРЈ¬НЁИлЖшМеУРПИәуЛіРт,УҰПИНЁИлЖшМеөД»ҜС§КҪ_______(Мо»ҜС§КҪ);Мј»ҜКұ·ўЙъ·ҙУҰөД»ҜС§·ҪіМКҪОӘ______ЎЈ
ЈЁ5Ј©°СCaCO3ЧЗТәөОИл1.0molL-1 өДNa2SO3ИЬТәЦРЈ¬ДЬ·сІъЙъCaSO3іБөн?_______ЎЈИфІ»ДЬ,ЛөГчФӯТт;ИфДЬ,ЗлҙУ¶ЁБҝөДҪЗ¶ИјтКцЕР¶ПТАҫЭЈә_______ЎЈ[ТСЦӘЈәKsp(CaSO3)=1.4ЎБ10-7Ј¬Ksp(CaCO3)=2.8ЎБ10-9]
ЈЁ6Ј©КФЙијЖјтөҘөДКөСй·Ҫ°ё,ЕР¶ПЛщөГМјЛбёЖСщЖ·ҝЕБЈКЗ·сОӘДЙГЧј¶Јә__________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФӘЛШAЎ«DКЗФӘЛШЦЬЖЪұнЦР¶МЦЬЖЪөДЛДЦЦФӘЛШЈ¬ёщҫЭұнЦРРЕПў»ШҙрПВБРОКМвЎЈ
ФӘЛШ | РФЦК»тҪб№№РЕПў |
A | өҘЦКЦЖіЙөДёЯС№өЖЈ¬·ўіцөД»Ж№вНёОнБҰЗҝЎўЙдіМФ¶ЎЈЗТЖдөҘЦКИјЙХәуЙъіЙөӯ»ЖЙ«№ММе |
B | өҘЦК·ЗіЈОИ¶ЁЈ¬КЗҝХЖшөДЦчТӘіЙ·ЦЦ®Т»ЎЈЖдФӯЧУөДЧоНвІгөзЧУКэКЗДЪІгөзЧУЧЬКэөД2.5ұ¶ |
C | өҘЦККЗЛ«ФӯЧУ·ЦЧУЈ¬іЈОВЎўіЈС№ПВКЗ»ЖВМЙ«ЖшМеЈ¬ФӯЧУөДMІгФЩФцјУТ»ёцөзЧУјҙҙпөҪОИ¶ЁҪб№№ |
D | +2јЫСфАлЧУөДәЛНвөзЧУЕЕІјУлДКФӯЧУПаН¬ |
(1)ЙПұнЛДЦЦФӘЛШГыіЖ·ЦұрОӘЈәA____Ј¬B____Ј¬C____Ј¬D____ЎЈ
(2)AЎўBЎўCЎўDФӯЧУ°лҫ¶УЙҙуөҪРЎөДЛіРтОӘ___ЎЈЈЁУГФӘЛШ·ыәЕМоРҙЈ©
(3)РҙіцBөДЖшМ¬Зв»ҜОпУлЖдЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОп·ҙУҰөДАлЧУ·ҪіМКҪ____ЎЈ
(4)УГөзЧУКҪұнКҫACөДРОіЙ№эіМ____ЎЈ
(5)CФӘЛШөДөҘЦКөДСх»ҜРФұИдеөҘЦКөДСх»ҜРФ____ЈЁМоЎ°ЗҝЎұ»тЎ°ИхЎұЈ©Ј¬ЗлЙијЖКөСйЦӨГч___ЎЈЈЁРҙКөСйІЩЧчәНПЦПуЈ©
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com