
【题目】甲醇不仅是重要的化工原料,而且还是性能优良的能源和车用燃料。
Ⅰ.甲醇水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源,生产过程中同时也产生CO,CO会损坏燃料电池的交换膜。相关反应如下:
反应①CH3OH(g) + H2O(g)CO2(g) + 3H2(g) △H1
反应②H2(g)+CO2(g)CO(g) + H2O(g) △H2=+41kJ/mol
如图表示恒压容器中0.5mol CH3OH(g)和0.5mol H2O(g)转化率达80%时的能量变化。
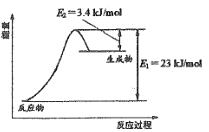
(1)计算反应①的△H1= ________。
(2)反应①能够自发进行的原因是________。升温有利于提高CH3OH转化率,但也存在一个明显的缺点是 _________。
(3)恒温恒容下,向密闭容器中通入体积比为1:1的H2和CO2,能判断反应CH3OH(g) + H2O(g)CO2(g) + 3H2(g)处于平衡状态的是____________。
A.体系内压强保持不变
B.体系内气体密度保持不变
C.CO2的体积分数保持不变
D.断裂3mol H-H键的同时断裂3mol H-O键
(4)250℃,一定压强和催化剂条件下,1.00mol CH3OH 和 1.32mol H2O充分反应,平衡测得H2为2.70mol,CO为 0.030mol,则反应①中CH3OH的转化率_________,反应②的平衡常数是 _________(以上结果均保留两位有效数字)。
Ⅱ.如图是甲醇燃料电池工作示意图:
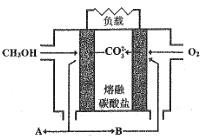
(5)当内电路转移1.5molCO32-时,消耗甲醇的质量是_________g。
(6)正极的电极反应式为 _______。
【答案】+49kJ/mol 该反应为熵增加的反应,熵增效应大于能量效应 CO含量增高,会破坏该电池的交换膜 ACD 91% 5.6×10-3 16g O2+2CO2+4e-=2CO32-
【解析】
(1)由图可知,0.5mol CH3OH(g)和0.5mol H2O(g)转化率达80%即0.4mol时吸收能量23kJ-3.4kJ=19.6kJ,计算1molCH3OH(g)和H2O(g)转化的能量可得;
(2)根据熵变分析;升温有利于提高CH3OH转化率,促进CO的生成,破坏电池交换膜;
(3)根据化学平衡状态特征:正逆反应速率相等,各组分含量保持不变分析;
(4)根据题意,衡时测得H2为2.70mol,CO为0.030mol,说明反应②生成的H2O(g)为0.03mol,消耗CO2(g)为0.03mol,参与反应②的H2为2.73mol,由反应①生成,则反应①生成CO2(g)为0.91mol,反应中的CO2(g)为0.88mol,根据反应①生成H2为2.73mol,生成CO2(g)为0.91mol,则参与反应的 CH3OH为0.91mol,H2O(g)为0.91mol,故装置中CH3OH为0.09mol,H2O(g)为1.32mol-0.91mol+0.03mol=0.44mol,H2为2.70mol,CO为0.030mol,CO2(g)为0.88mol,结合转化率=变化量除以起始量和反应②的K= ![]() 计算;
计算;
(5)甲醇燃料电池甲醇为负极,电极反应为:2CH3OH-12e-+6CO32-=8CO2+4H2O,据此计算;
(6)正极为氧气发生氧化反应,结合电解质可得。
(1)由图可知,0.5mol CH3OH(g)和0.5mol H2O(g)转化率达80%即0.4mol时吸收能量23kJ-3.4kJ=19.6kJ,则1molCH3OH(g)和H2O(g)转化的能量![]() =49kJ,故反应①的△H1=+49kJ/mol;
=49kJ,故反应①的△H1=+49kJ/mol;
(2)反应①的△H>0,但熵增加△S>0,根据△G=△H-T△S<0时反应自发进行可知当达到一定温度时,该反应可以自发进行,即该反应能自发进行是由于熵增效应大于能量效应;升温有利于提高CH3OH转化率,促进CO的生成,提高CO的产量,但CO会破坏该电池的交换膜;
(3)A.该反应前后气体系数之和不同,平衡移动过程中压强会发生变化,所以体系内压强保持不变时说明反应达到平衡,故A正确;
B.体系内混合气体总质量保持不变,恒容体积不变,气体密度始终保持不变,不能判断化学平衡,故B错误;
C.反应达到平衡时各组分含量保持不变,所以CO2的体积分数保持不变说明反应达到平衡,故C正确;
D.断裂3mol H-H键的同时断裂3mol H-O键,说明消耗3mol氢气的同时消耗1mol甲醇和1mol水,说明正逆反应速率相等,反应达到平衡,故D正确;
综上所述选ACD;
(4)根据题意,衡时测得H2为2.70mol,CO为0.030mol,说明反应②生成的H2O(g)为0.03mol,消耗CO2为0.03mol,则反应①生成的H2为2.73mol,则反应①生成CO2为0.91mol,平衡时的CO2为0.88mol;反应①生成H2为2.73mol,生成CO2为0.91mol,则转化的 CH3OH为0.91mol,H2O为0.91mol,故平衡时CH3OH为0.09mol,H2O为1.32mol-0.91mol+0.03mol=0.44mol,H2为2.70mol,CO为0.030mol,CO2为0.88mol,所以甲醇的转化率为![]() =91%;反应②为前后气体系数之和相等的可逆反应,所以计算平衡常数时可用物质的量代替浓度,所以平衡常数K=
=91%;反应②为前后气体系数之和相等的可逆反应,所以计算平衡常数时可用物质的量代替浓度,所以平衡常数K=![]() =5.6×10-3;
=5.6×10-3;
(5)甲醇燃料电池甲醇为负极,电极反应为:2CH3OH-12e-+6CO32-=8CO2+4H2O,当内电路转移1.5mol CO32-时,消耗甲醇为0.5mol,故消甲醇的质量是0.5mol×32g/mol=16g;
(6)通入氧气的一极为正极,结合负极产生的二氧化碳生成碳酸根,电极方程式为O2+2CO2+4e-=2CO32-。


科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出由 WO3 催化乙烯和 2-丁烯合成丙烯的反应历程如图(所有碳原子满足最外层八电子结构)。下列说法不正确的是
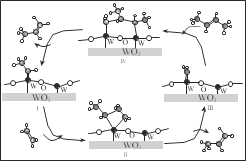
A.乙烯、丙烯和 2-丁烯互为同系物
B.乙烯、丙烯和 2-丁烯的沸点依次升高
C.Ⅲ→Ⅳ中加入的 2-丁烯具有反式结构
D.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)可用作抗氧剂等,工业上常用尿素[CO(NH2)2]和 NaClO溶液反应制备水合肼。
已知:Ⅰ.N2H4·H2O 的结构如图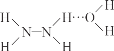 (…表示氢键)。
(…表示氢键)。
Ⅱ.N2H4·H2O 沸点 118 ℃,具有强还原性。
(1)将 Cl2 通入过量 NaOH 溶液中制备 NaClO,得到溶液 X,离子方程式是__。
(2)制备水合肼:将溶液 X 滴入尿素水溶液中,控制一定温度,装置如图 a(夹持及控温装置已略)。充分反应后,A 中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品 NaCl 和Na2CO3·10H2O。

①A 中反应的化学方程式是__。
②冷凝管的作用是__。
③若滴加 NaClO 溶液的速度较快时,水合肼的产率会下降,原因是__。
④NaCl 和 Na2CO3 的溶解度曲线如图 b。由蒸馏后的剩余溶液获得 NaCl 粗品的操作是__。
(3)水合肼在溶液中可发生类似 NH3·H2O 的电离,呈弱碱性;其分子中与 N 原子相连的 H 原子易发生取代反应。
①水合肼和盐酸按物质的量之比 1∶1 反应的离子方程式是__。
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与 DEC( ![]() )发生取代反应制得。碳酰肼的结构简式是__。
)发生取代反应制得。碳酰肼的结构简式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制![]() 的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
A.①②B.③C.③④D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
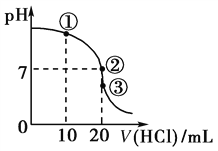
A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述正确的是( )
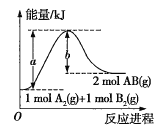
A.该反应是放热反应
B.由图可知,1molA2(g)和1molB2(g)反应生成2molAB(g)放出bkJ热量
C.由图可知,1molA2(g)和1molB2(g)反应生成2molAB(g)吸收bkJ热量
D.由图可知,1molA2(g)和1molB2(g)反应生成2molAB(g)吸收(a-b)kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的开关时,观察到电流表的指针发生了偏转。
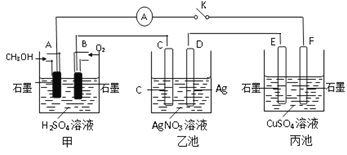
请回答下列问题:
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_________________________。
(2)乙池中C(石墨)电极的名称为____(填“正极”“负极”或“阴极”“阳极”),总反应的化学方程式为_________________________。
(3)当乙池中D极质量增加5.4g时,甲池中理论上消耗O2的体积为_____mL(标准状况),转移的电子数为__________
(4)丙池中_____(填“E”或“F”)极析出铜。
(5)若丙中电极不变,将其溶液换成NaCl溶液,开关闭合一段时间后,丙中溶液的pH将_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NCl3是一种黄色粘稠状液体,常用干杀菌消毒,工业上通过情性电极电解氯化铵和盐酸的方法制备NCl3,其原理如图所示。下列说法正确的是
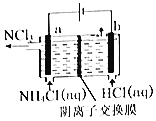
A.在b极区产生的气体是H2
B.a极的电极反应式为NH4+-6e-+ 4OH-+3Cl-=NCl3+4H2O
C.溶液中的Cl-移向a极区
D.若将阴离子交换膜改为阳离子交换膜,NH4Cl的利用率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com