
(15分)某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
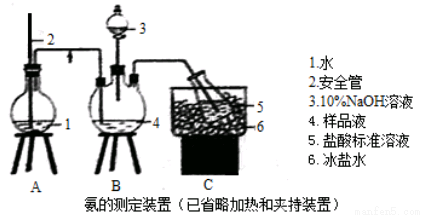
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
当A中压力过大时,安全管中液面上升,使A瓶中压力稳定
碱 酚酞(或甲基红)
偏低
防止硝酸银见光分解 2.8×10—3
+3 2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
【解析】
试题分析:(1)分析题给装置知,装置中安全管的作用原理是当A中压力过大时,安全管中液面上升,使A瓶中压力稳定。(2)用NaOH标准溶液滴定过剩的HCl时,应使用碱式滴定管,可使用的指示剂为酚酞(或甲基红)。(3)根据题给信息知,氨的测定过程中发生反应HCl+NH3 NH4Cl,则样品中氨的物质的量与和氨气反应的HCl的物质的量相等,为(c1V1—c2V2)×10—3mol,则氨气的质量为
NH4Cl,则样品中氨的物质的量与和氨气反应的HCl的物质的量相等,为(c1V1—c2V2)×10—3mol,则氨气的质量为
(c1V1—c2V2)×10—3×17g,质量分数表达式为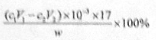 。(4)测定氨前应该对装置进行气密性检验,若气密性不好会导致氨气逸出,测定结果将偏低。(5)测定氯的过程中,用硝酸银溶液滴定,硝酸银见光易分解,故使用棕色滴定管的原因是防止硝酸银见光分解;根据沉淀溶解平衡知识知,c(CrO42—) =Ksp(Ag2CrO4)/ c2(Ag+)= 1.12×10—12/(2.0×10—5)2=2.8×10—3mol·L—1。(6)根据题意知,样品X中钴、氨、氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,利用化合价规则判断,钴的化合价为+3;根据题给信息知,CoCl2·6H2O、NH4Cl、H2O2、浓氨水在活性炭催化下,合成橙黄色晶体X,化学方程式为2CoCl2+2NH4Cl+10NH3+H2O2
。(4)测定氨前应该对装置进行气密性检验,若气密性不好会导致氨气逸出,测定结果将偏低。(5)测定氯的过程中,用硝酸银溶液滴定,硝酸银见光易分解,故使用棕色滴定管的原因是防止硝酸银见光分解;根据沉淀溶解平衡知识知,c(CrO42—) =Ksp(Ag2CrO4)/ c2(Ag+)= 1.12×10—12/(2.0×10—5)2=2.8×10—3mol·L—1。(6)根据题意知,样品X中钴、氨、氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,利用化合价规则判断,钴的化合价为+3;根据题给信息知,CoCl2·6H2O、NH4Cl、H2O2、浓氨水在活性炭催化下,合成橙黄色晶体X,化学方程式为2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O;X的制备过程中温度不能过高的原因是温度过高过氧化氢分解、氨气逸出。
2[Co(NH3)6]Cl3+2H2O;X的制备过程中温度不能过高的原因是温度过高过氧化氢分解、氨气逸出。
考点:考查物质组成的实验测定,涉及化学实验基本操作、化学方程式的书写、实验方案分析及相关计算。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(重庆卷解析版) 题型:选择题
下列实验可实现鉴别目的的是
A.用KOH溶液鉴别SO3(g)和SO2
B.用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2
C.用CO2鉴别NaAlO2溶液和CH3COONa溶液
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(浙江卷解析版) 题型:选择题
下列说法正确的是
A.乳酸薄荷醇酯( 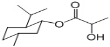 )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛(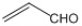 )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C.淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(江苏卷解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(江苏卷解析版) 题型:选择题
下列关于化学用语的表示正确的是s
A.过氧化钠的电子式:
B.质子数为35、中子数为45的溴原子: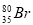
C.硫离子的结构示意图: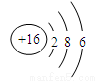
D.间二甲苯的结构简式: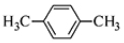
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标Ⅱ卷解析版) 题型:选择题
一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D.pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:填空题
〔化学—选修2:化学与技术〕(15分)
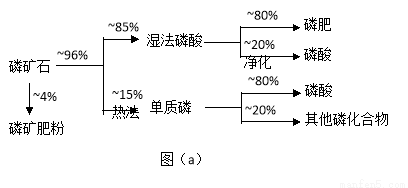
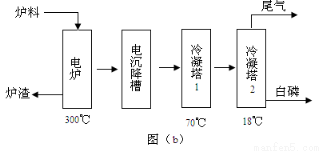
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca3(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 |
白磷 | 44 | 280.5 |
|
PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为: 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去
再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(广东卷解析版) 题型:选择题
常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
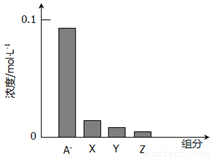
A.HA是强酸
B.该混合液pH=7
C.图中x表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(四川卷解析版) 题型:推断题
(16分)A是一种有机合成中间体,其结构简式为: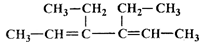 。A的合成路线如下图,其中B~H分别代表一种有机物。
。A的合成路线如下图,其中B~H分别代表一种有机物。
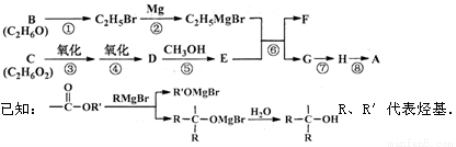
请回答下列问题:
(1)A中碳原子的杂化轨道类型有_____;A的名称(系统命名)是____;第⑧步反应类型是___。
(2)第①步反应的化学方程式是________。
(3)C物质与CH2=C(CH3)COOH按物质的量之比1:1反应,其产物经加聚得到可作隐形眼镜的镜片材料I。I的结构简式是_______________。
(4)第⑥步反应的化学方程式是________________。
(5)写出含有六元环,且一氯代物只有2种(不考虑立体异构)的A的同分异构体的结构简式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com