
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| B. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ | |
| D. | FeSO4溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O |
分析 A.漏写铵根离子与碱的反应;
B.电子、电荷不守恒;
C.电子、电荷不守恒;
D.发生氧化还原反应生成硫酸铁、水.
解答 解:A.NH4HCO3溶于过量的NaOH溶液中的离子反应为NH4++HCO3-+OH-=CO32-+NH3.H2O+H2O,故A错误;
B.将少量金属钠放入冷水中的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.FeCl3溶液与Cu的反应的离子反应为Cu+2Fe3+=Cu2++2Fe2+,故C错误;
D.FeSO4溶液中加入H2O2的离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: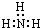 | B. | CS2分子的结构式:S═C═S | ||
| C. | S2-的结构示意图: | D. | CH4的分子模型示意图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| ① | |||||||
| ② | ③ | ④ | |||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 ,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.
,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$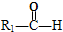 +
+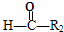 ,
,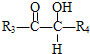 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$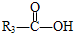 +
+
 .
. .
.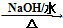 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 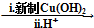 HCOOH
HCOOH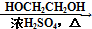 HCOOCH2CH2OOCH(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)
HCOOCH2CH2OOCH(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与过量稀硫酸反应:Ba2++OH-+SO42-+H+=H2O+BaSO4↓ | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 氯化镁溶液与过量的氨水反应:Mg2++2OH-=Mg(OH)2↓ | |
| D. | 稀硫酸与过量的铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,若A是共价化合物,0.1molA分子中含有的质子数可能为NA | |
| D. | 用足量CO还原磁铁矿得到9mol铁时转移24mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
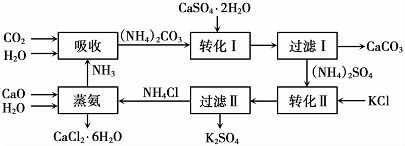
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解得量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com