
”¾ĢāÄæ”æČēĶ¼ŹĒÓĆ0.1000mol/LµÄŃĪĖįµĪ¶ØijĪ“ÖŖÅØ¶ČµÄNaOHČÜŅŗµÄŹ¾ŅāĶ¼ŗĶij“ĪµĪ¶ØĒ°”¢ŗóµÄŹ¢·ÅŃĪĖįµĪ¶Ø¹ÜÖŠŅŗĆęµÄĪ»ÖĆ£®Ēė»Ų“š£ŗ 
£Ø1£©ŅĒĘ÷AµÄĆū³ĘŹĒ£»
£Ø2£©ŃĪĖįµÄĢå»ż¶ĮŹż£ŗ
µĪ¶ØĒ°¶ĮŹżĪŖmL£¬
µĪ¶Øŗó¶ĮŹżĪŖmL£®
£Ø3£©Ä³ŹµŃ銔×éĶ¬Ń§µÄČż“ĪŹµŃéµÄŹµŃ鏿¾ŻČēĻĀ±ķĖłŹ¾£® øł¾Ż±ķÖŠŹż¾Ż¼ĘĖć³öµÄ“ż²āNaOHČÜŅŗµÄĘ½¾łÅØ¶ČŹĒmol/L£®£Ø±£ĮōĖÄĪ»ÓŠŠ§Źż×Ö£©
ŹµŃé | “ż²āNaOHČÜŅŗµÄĢå»ż£ØmL£© | µĪ¶ØĒ°ŃĪĖįµÄ | µĪ¶ØŗóŃĪĖįµÄ |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
£Ø4£©ČōÓĆ·ÓĢŖ×öÖøŹ¾¼Į£¬ÅŠ¶Ļµ½“ļµĪ¶ØÖÕµćµÄŹµŃéĻÖĻóŹĒ
£Ø5£©¶ŌĻĀĮŠ¼øÖÖ¼Ł¶ØĒéæö½ųŠŠĢÖĀŪ£ŗ£ØĢī”°ĪŽÓ°Ļģ”±”¢”°Ę«øß”±”¢”°Ę«µĶ”±£©
¢ŁČōµĪ¶ØĒ°×¶ŠĪĘæĪ“ÓĆ“ż²āŅŗČóĻ“£¬¶Ō²ā¶Ø½į¹ūµÄÓ°ĻģŹĒ£»
¢ŚČ”“ż²āŅŗµÄµĪ¶Ø¹Ü£¬µĪ¶ØĒ°µĪ¶Ø¹Ü¼ā¶ĖÓŠĘųÅŻ£¬µĪ¶ØŗóĘųÅŻĻūŹ§£®
¢Ū±ź×¼Ņŗ¶ĮŹżŹ±£¬ČōµĪ¶ØĒ°ŃöŹÓ£¬µĪ¶Øŗóø©ŹÓ£¬¶Ō²ā¶Ø½į¹ūµÄÓ°ĻģŹĒ £®
”¾“š°ø”æ
£Ø1£©ĖįŹ½µĪ¶Ø¹Ü
£Ø2£©0.80£»22.80
£Ø3£©0.1100
£Ø4£©µ±ČÜŅŗŃÕÉ«ÓÉ·ŪŗģÉ«±äĪŖĪŽÉ«£¬ĒŅ°ė·ÖÖÓÄŚ²»±äÉ«
£Ø5£©ĪŽÓ°Ļģ£»Ę«øߣ»Ę«µĶ
”¾½āĪö”æ½ā£ŗ£Ø1£©øƵĪ¶Ø¹ÜµÄĻĀ¶ĖŹĒ²£Į§»īČū£¬ĖłŅŌŅĒĘ÷µÄĆū³ĘĪŖĖįŹ½µĪ¶Ø¹Ü£¬
ĖłŅŌ“š°øŹĒ£ŗĖįŹ½µĪ¶Ø¹Ü£»£Ø2£©µĪ¶ØĒ°£¬µĪ¶Ø¹ÜÖŠµÄŅŗĆę¶ĮŹżĪŖ0.80mL£¬µĪ¶Øŗ󣬵Ī¶Ø¹ÜÖŠµÄŅŗĆę¶ĮŹżĪŖ22.80mL£¬
ĖłŅŌ“š°øŹĒ£ŗ0.80£»22.80£»£Ø3£©Čż“ĪµĪ¶ØĻūŗĵÄĢå»żĪŖ£ŗ22.02mL£¬22.00mL£¬21.98mL£¬Źż¾Ż¾łÓŠŠ§£¬ŌņĘ½¾łĻūŗÄV£ØNaOH£©=22.00mL£¬c£Ø“ż²ā£©= ![]() =
=![]() =0.1100molL©1 £¬
=0.1100molL©1 £¬
ĖłŅŌ“š°øŹĒ£ŗ0.1100£»£Ø4£©µĪ¶ØŹ±£¬µ±ČÜŅŗŃÕÉ«ÓÉ·ŪŗģÉ«±äĪŖĪŽÉ«£¬ĒŅ°ė·ÖÖÓÄŚ²»±äÉ«£¬æÉĖµĆ÷“ļµ½µĪ¶ØÖÕµć£¬
ĖłŅŌ“š°øŹĒ£ŗµ±ČÜŅŗŃÕÉ«ÓÉ·ŪŗģÉ«±äĪŖĪŽÉ«£¬ĒŅ°ė·ÖÖÓÄŚ²»±äÉ«£»£Ø5£©¢ŁČōµĪ¶ØĒ°×¶ŠĪĘæĪ“ÓĆ“ż²āŅŗČóĻ“£¬“ż²āŅŗµÄĪļÖŹµÄĮæ²»±ä£¬±ź×¼ŅŗµÄĢå»żŅ²²»±ä£¬øł¾Żc£Ø“ż²ā£©= ![]() ·ÖĪö£¬²ā¶Ø½į¹ūĪŽÓ°Ļģ£»
·ÖĪö£¬²ā¶Ø½į¹ūĪŽÓ°Ļģ£»
¢ŚČ”“ż²āŅŗµÄµĪ¶Ø¹Ü£¬µĪ¶ØĒ°µĪ¶Ø¹Ü¼ā¶ĖÓŠĘųÅŻ£¬µĪ¶ØŗóĘųÅŻĻūŹ§£¬µ¼ÖĀ±ź×¼ŅŗµÄĢå»żĘ«“ó£¬øł¾Żc£Ø“ż²ā£©= ![]() ·ÖĪö£¬²ā¶Ø½į¹ūĘ«øߣ»
·ÖĪö£¬²ā¶Ø½į¹ūĘ«øߣ»
¢Ū±ź×¼Ņŗ¶ĮŹżŹ±£¬ČōµĪ¶ØĒ°ŃöŹÓ£¬µĪ¶Øŗóø©ŹÓ£¬µ¼ÖĀ±ź×¼ŅŗµÄĢå»żĘ«Š”£¬øł¾Żc£Ø“ż²ā£©= ![]() ·ÖĪö£¬²ā¶Ø½į¹ūĘ«µĶ£»
·ÖĪö£¬²ā¶Ø½į¹ūĘ«µĶ£»
ĖłŅŌ“š°øŹĒ£ŗĪŽÓ°Ļģ£»Ę«øߣ»Ę«µĶ£®
”¾æ¼µć¾«Īö”æ¹ŲÓŚ±¾Ģāæ¼²éµÄĖį¼īÖŠŗĶµĪ¶Ø£¬ŠčŅŖĮĖ½āÖŠŗĶµĪ¶ØŹµŃ鏱£¬ÓĆÕōĮóĖ®Ļ“¹żµÄµĪ¶Ø¹ÜĻČÓƱź×¼ŅŗČóĻ“ŗóŌŁ×°±ź×¼Ņŗ£»ĻČÓĆ“ż²āŅŗČóĻ“ŗóŌŚŅĘČ”ŅŗĢ壻µĪ¶Ø¹Ü¶ĮŹżŹ±ĻȵČŅ»¶ž·ÖÖÓŗóŌŁ¶ĮŹż£»¹Ū²ģ׶ŠĪĘæÖŠČÜŅŗŃÕÉ«µÄøı䏱£¬ĻȵȰė·ÖÖÓŃÕÉ«²»±äŗó¼“ĪŖµĪ¶ØÖÕµć²ÅÄÜµĆ³öÕżČ·“š°ø£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČĖĄąŹ×“ĪŗĻ³ÉµÄ¾ßÓŠÉśĆü»īŠŌµÄµ°°×ÖŹŹĒ £Ø £©
A. ĆĄ¹śÓŠ»ś»Æѧ¼ŅŗĻ³ÉµÄŅ¶ĀĢĖŲ B. ÖŠ¹śÓŠ»ś»Æѧ¼ŅŗĻ³ÉµÄ½į¾§Å£ŅȵŗĖŲ
C. ČÕ±¾»Æѧ¼ŅŗĻ³ÉµÄą×ą¤ĄąĪļÖŹ D. ¶ķ¹śæĘѧ¼ŅŗĻ³ÉµÄŗĖĢĒŗĖĖįĄąĪļÖŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬ŌŚŗ¬ÓŠPb2+”¢Sn2+µÄijČÜŅŗÖŠ£¬¼ÓČė¹żĮ潚ŹōĪż£ØSn£©£¬·¢Éś·“Ó¦£ŗSn£Øs£©+Pb2+£Øaq£©Sn2+£Øaq£©+Pb£Øs£©£¬ĢåĻµÖŠc£ØPb2+£©ŗĶc£ØSn2+£©±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ£Ø £© 
A.ĶłĘ½ŗāĢåĻµÖŠ¼ÓČė½šŹōĒ¦ŗó£¬c£ØPb2+£©Ōö“ó
B.ĶłĘ½ŗāĢåĻµÖŠ¼ÓČėÉŁĮæSn£ØNO3£©2¹ĢĢåŗó£¬c£ØPb2+£©±äŠ”
C.ÉżøßĪĀ¶Č£¬Ę½ŗāĢåĻµÖŠc£ØPb2+£©Ōö“ó£¬ĖµĆ÷øĆ·“Ó¦”÷H£¾0
D.25”ꏱ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=2.2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņ2.0LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1.0mol PCl5 £¬ ŌŚĪĀ¶ČĪŖTŹ±·¢ÉśČēĻĀ·“Ó¦PCl5£Øg£©PCl3£Øg£©+Cl2£Øg£©”÷H=+124kJmol©1 £® ·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
Ź±¼ät/s | 0 | 50 | 150 | 250 | 350 |
n£ØPCl3£©/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©·“Ó¦ŌŚĒ°50sµÄĘ½¾łĖŁĀŹv£ØPCl5£©= £¬ øĆ·“Ó¦µÄ”÷S0£ØĢī”°£¼”±”¢”°£¾”±»ņ”°=”±£©£®
£Ø2£©ĪĀ¶ČĪŖTŹ±£¬øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż= £®
£Ø3£©ÉĻŹö·“Ó¦µ½“ļĘ½ŗāדĢ¬Ź±£¬PCl3µÄĢå»ż·ÖŹżĪŖ £®
ŅŖĢįøßĘ½ŗāŹ±PCl3µÄĢå»ż·ÖŹż£¬æɲÉČ”µÄ“ėŹ©ÓŠ £®
A£®ĪĀ¶Č²»±ä£¬Ń¹ĖõČŻĘ÷Ģå»żŌö“óŃ¹Ēæ B£®Ź¹ÓĆøߊ§“߻ƼĮ
C£®ĪĀ¶ČŗĶĢå»ż²»±ä£¬¼õŠ”PCl5µÄĘšŹ¼Įæ D£®Ģå»ż²»±ä£¬Ģįøß·“Ó¦ĪĀ¶Č
£Ø4£©ŌŚĪĀ¶ČĪŖTŹ±£¬ČōĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė0.5mol PCl5ŗĶa mol Cl2Ę½ŗāŹ±PCl5µÄ×Ŗ»ÆĀŹČŌĪŖ20%£¬Ōņa= £®
£Ø5£©ŌŚČČĖ®ÖŠ£¬ĪåĀČ»ÆĮ×ĶźČ«Ė®½ā£¬Éś³ÉĮ×Ėį£ØH3PO4£©£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖA”¢B”¢C”¢D”¢E”¢F”¢G”¢H”¢I¾ÅÖÖĪļÖŹ£¬ĘäÖŠA”¢B”¢D”¢EŃęÉ«·“Ó¦¾łĪŖ×ĻÉ«(Ķø¹żĄ¶É«īܲ£Į§)£¬G”¢FŹĒµ„ÖŹ£¬ĘäÓą¾łĪŖ»ÆŗĻĪļ£¬HŹĒŅ»ÖÖµ»ĘÉ«¹ĢĢ壬ĖüĆĒµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£Ēė»Ų“š£ŗ

(1)»³öGĄė×Ó½į¹¹Ź¾ŅāĶ¼________£»
(2)Š“³öB”¢IµÄ»ÆѧŹ½B________£¬I________£»
(3)Š“³öHµÄŅ»ÖÖÓĆĶ¾__________________________________£»
(4)Š“³öAŹÜČČ·Ö½āµÄ»Æѧ·½³ĢŹ½_________________________£»
(5)ČōHÓėC·“Ó¦¹ĢĢåŌöÖŲ4.2 g£¬Ōņ²Ī¼Ó·“Ó¦µÄCĘųĢåŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ________L”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§ÉśæĪĶā»ī¶ÆŠ”×飬ģÄāŗōĪüĆę¾ßÖŠµÄ·“Ó¦ŌĄķ£¬Éč¼ĘÓĆČēĶ¼ĖłŹ¾µÄŅĒĘ÷Ą“ÖĘČ”ŃõĘų²¢²āĮæŃõĘųµÄĢå»ż”£Ķ¼ÖŠĮæĘų×°ÖĆEÓɼה¢ŅŅĮ½øł²£Į§¹Ü×é³É£¬ĖüĆĒÓÉĻšĘ¤¹ÜĮ¬ĶØ£¬²¢×°ČėŹŹĮæĖ®”£¼×¹ÜÓŠæĢ¶Č(0”«50 mL)£¬¹©ĮæĘųÓĆ£¬ŅŅ¹ÜæÉÉĻĻĀŅĘ¶Æµ÷½ŚŅŗĆęøßµĶ”£ŹµŃéæɹ©Ń”ÓƵÄŅ©Ę·»¹ÓŠ£ŗĻ”ĮņĖį”¢ŃĪĖį”¢¹żŃõ»ÆÄĘ”¢Ģ¼ĖįÄĘ”¢“óĄķŹÆ”¢Ė®”£
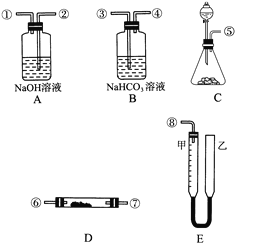
ŹŌ»Ų“š£ŗ
(1)Ķ¼ÖŠø÷×°ÖĆ½ÓæŚĮ¬½ÓĖ³ŠņŹĒ________(Ģīø÷½ÓæŚµÄ±ąŗÅ£¬ĘäÖŠĮ¬½Ó½ŗ¹Ü¼°¼Š³Ö×°ÖĆ¾łŹ”ĀŌ)”£
(2)×°ÖĆCÖŠ·ÅČėµÄ·“Ó¦ĪļŹĒ________ŗĶ________”£
(3)×°ÖĆAµÄ×÷ÓĆŹĒ______________£¬×°ÖĆBµÄ×÷ÓĆŹĒ____________”£
(4)ĪŖĮĖ½Ļ×¼Č·²āĮæŃõĘųµÄĢå»ż£¬³żĮĖ±ŲŠė¼ģ²éÕūøö×°ÖƵÄĘųĆÜŠŌÖ®Ķā£¬ŌŚ¶Į·“Ó¦Ē°ŗó¼×¹ÜÖŠŅŗĆęµÄ¶ĮŹż¼°ĒóĘä²īÖµµÄ¹ż³ĢÖŠ£¬Ó¦×¢Ņā________ŗĶ________”£
a£®ŹÓĻßÓė°¼ŅŗĆę×īµĶ“¦ĻąĘ½
b£®µČ“żĘ¬æĢ£¬“żŅŅ¹ÜÖŠŅŗĆę²»ŌŁÉĻÉżŹ±Į¢æĢ¶ĮŹż
c£®¶ĮŹżĒ°Ó¦ÉĻĻĀŅʶÆŅŅ¹Ü£¬Ź¹¼×”¢ŅŅĮ½¹ÜŅŗĆęĻąĘ½
d£®¶ĮŹżŹ±²»Ņ»¶ØŹ¹¼×”¢ŅŅĮ½¹ÜŅŗĆęĻąĘ½
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶ¬Ń§ŌŚŹµŃé±ØøęÖŠ¼ĒĀ¼ĻĀĮŠŹż¾Ż£¬ĘäÖŠÕżČ·µÄŹĒ£Ø £©
A. ÓĆ 25mL ĮæĶ²ĮæČ” 12.36mL ŃĪĖį
B. ÓĆĶŠÅĢĢģĘ½³ĘĮæ 8.75g Ź³ŃĪ
C. ÅäÖĘ 450mL 1 mol/L µÄ NaCl ČÜŅŗÓĆ 500mL µÄČŻĮæĘæ
D. ÓĆ¹ć·ŗ pH ŹŌÖ½²āµĆijČÜŅŗµÄ pH ĪŖ 3.5
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Æѧ³ÉĪŖŅ»ĆÅæĘѧ²¢½Ļæģ·¢Õ¹£¬Ź¼ÓŚ(””””)
A.ÉįĄÕ·¢ĻÖŃõĘųB.ÖŹĮæŹŲŗć¶ØĀɵķ¢ĻÖ
C.Ō×Ó”Ŗ·Ö×ÓѧĖµµÄĪŹŹĄD.ÖŠ¹śŹŖ·ØŅ±½š¼¼ŹõµÄĶĘ¹ć
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°Ń1.1 gĢś”¢ĀĮ»ģŗĻĪļČÜÓŚ200 mL 5 mol”¤L£1ŃĪĖįÖŠ£¬·“Ó¦ŗóŃĪĖįµÄÅØ¶Č±äĪŖ4.6 mol”¤L£1(ČÜŅŗĢå»ż±ä»ÆŗöĀŌ²»¼Ę)”£Ēó£ŗ
(1)·“Ó¦ÖŠĻūŗÄHClµÄĪļÖŹµÄĮ棻
(2)øĆ»ģŗĻĪļÖŠĀĮ”¢ĢśµÄĪļÖŹµÄĮ攣
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com